BGU 03 :
Chapitre 11, Les différents modes d’action des hormones.
Neurotransmetteurs et hormones n’agissent pas de la même façon : le mode d’action sur les cellules cibles sera différent.
On trouve en fait deux familles de molécules informatives à mode d’action différent :
- Les molécules hydrophiles : Quand il y a contact avec la membrane plasmique de la cellule cible, ces molécules ne rentrent pas ; elles ont besoin d’un système de reconnaissance capable de générer des effets dans la cellule pour provoquer l’effet biologique souhaité.
- Les molécules lipophiles : Ces molécules rentrent plus facilement dans la cellule cible et vont agir rapidement sur la cible intracellulaire (récepteurs).
Télécharger le document sur le serveur FTP ou sur le serveur web (HTTP).
I Les molécules hydrophiles.
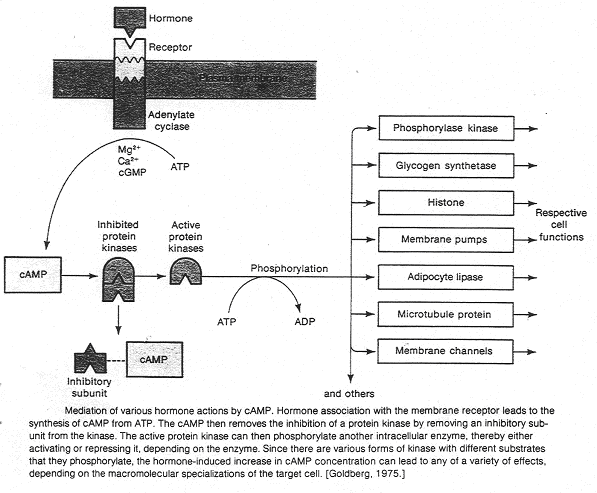
Dans ce cas, une glande va sécréter un premier messager qui va agir sur la cellule cible par l’intermédiaire d’un récepteur. Ce dernier n’est pas capable de générer un effet biologique dans la cellule. Le récepteur va récupérer le signal extérieur, sa liaison avec le messager primaire va activer une enzyme permettant la synthèse d’un second messager. Un récepteur est spécifique à une molécule. La formation du couple messager/récepteur entraîne l’activation d’un système de transduction qui peut stimuler une enzyme, un canal ionique afin de provoquer une réponse intracellulaire.
Ici, c’est l’adénylyl-cyclase qui transforme l’ATP en AMPc.
A La spécificité.
La quantité d’hormones entrant en contact avec le récepteur est très faible. Le système doit être très spécifique, à haute affinité pour que l’interaction hormone/récepteur soit réalisable. Cette interaction a un effet biologique sur la cellule cible.
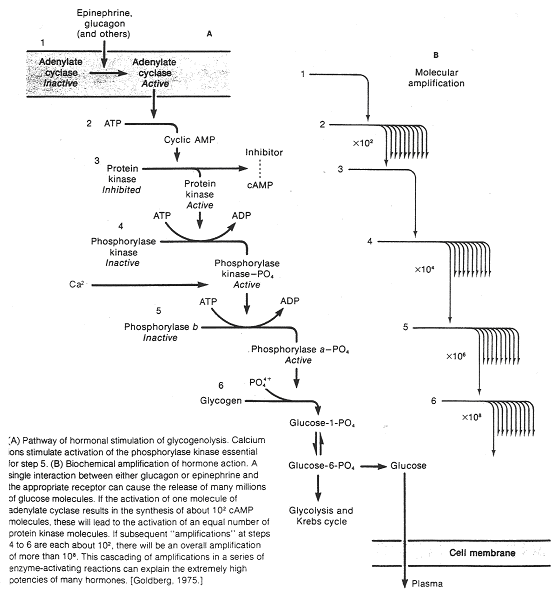
Le second messager peut être responsable d’un système d’amplification que l’on peut évaluer : une molécule d’adrénaline ou de glucagon va provoquer la synthèse de 100 molécules d’AMPc. Ces dernières (deux par enzyme) vont activer une enzyme (protéine-kinase A) qui elle, active la phosphorylase-kinase. Cette dernière provoque, sur la suite de la chaîne, une très forte amplification intracellulaire.
B Les RCPG (Récepteurs Couplés aux Protéines G).

Le récepteur est une protéine qui traverse sept fois la membrane. Cette protéine est structurée en hélice a-transmembranaires. Chaque segment (ou hélice) a un rôle propre.
Les protéines G sont sous la membrane, accrochées à celle-ci par un lipide, ajouté durant la modification post-traductionnelle. Les protéines G sont mobiles sous la membrane. Ces protéines sont composées de trois sous-unités, α, ß, γ, qui peuvent être dissociées.
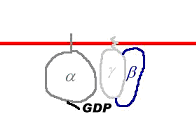
La liaison au GDP a lieu au niveau d’α.
Lorsque l’hormone arrive sur le récepteur :
- Elle est reconnue grâce à des spécificités dues aux parties externes.
- Il y a interaction car les sept domaines sont en cercle. Cet agencement crée au milieu, une micro-région très hydrophile (c’est la poche de liaison) où vient le ligand. Les petits messagers moléculaires vont se fixer dans la membrane. Les gros (peptides) provoqueront une interaction au niveau de l’interface externe.
Ces récepteurs hydrophiles sont des protéines qui reconnaissent de nombreuses molécules :
- Les gros peptides : FSH, LH.
- Les petits peptides : petites hormones…
- Les catécholamines : adrénaline…
Ces récepteurs sont aussi capables de transmettre les informations portées par les lipides, les phospholipides. Ils jouent aussi un rôle dans la réceptions des odeurs et permettent la perception de la lumière (la lumière active un récepteur couplé à une protéine G). La régulation de la concentration en Ca2+ par la parathormone (libération de Ca2+) et la calcitonine (stockage de Ca2+) est aussi sous l’action de récepteurs couplés à des protéines G.
C Fonctionnement de l’ensemble « hormone-récepteur-protéineG-effecteur ».
La fixation de l’hormone sur son récepteur provoque un changement conformationnel qui permet à la troisième boucle cytoplasmique et à la région interne (du récepteur) d’interagir avec la protéine G. La nouvelle forme obtenue à une grande affinité pour cette protéine G.
La liaison récepteur/protéine G entraîne le remplacement du GDP par du GTP car il y a un changement d’affinité. Ce remplacement provoque la séparation du trimère en sous-unité α libre et un ensemble des deux sous-unités restantes (ß et ?). α va présenter une conformation affine pour l’effecteur (a est toujours associée au récepteur). Cet effecteur va être activé par α car celle-ci est une GTPase (qui hydrolyse le GTP en GDP). L’adénylyl-cyclase (l’effecteur) va alors transformer l’ATP en AMPc.
Comme l’affinité de α-GDP pour l’effecteur est quasi nulle, l’ensemble ß-γ va revenir.
C’est le retour à l’état initial.
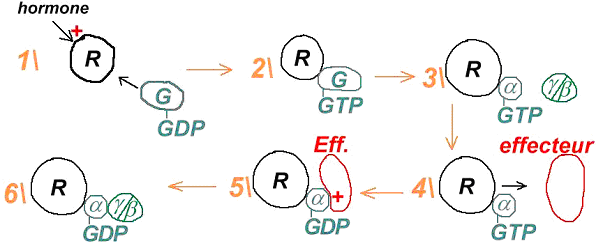
Les unités ß et γ sont responsables de toutes les interactions : des régulations de la réaction avec l’adénylyl-cyclase. Elles vont activer ou inhiber cette cyclase en fonction de la sous-unité de cette enzyme qui va être touchée.
Les récepteurs sont différents au niveau de leur composition et au niveau de la transduction. C’est la protéine G qui va faire varier l’effecteur utilisé. Il existe un classement des protéines G en fonction des toxines les inhibant :
- Toxine cholérique –> reconnaît la famille des protéines G1 qui active l’adénylyl-cyclase.
- Toxine pertussique (coqueluche) –> reconnaît la famille des protéines Gi qui inhibe l’adénylyl-cyclase. La toxine pertussique inhibe Gi, donc permet l’activation de la cyclase.
- La famille des protéines Gq est sensible aux deux toxines et elle permet l’activation de la PLC (PhosphoLipase Kinase).
D La PhosphoLipase C.
Cette va agir spécifiquement sur les phospholipides :
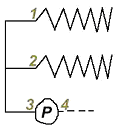
- Les PLC PLA1 vont cliver en 1.
- Les PLC PLA2 clivent en 2 (souvent l’acide arachidonique).
- Les PLC PLc clivent en 3 (avant le phosphate).
- Les PLC PLd clivent en 4, après le phosphate.
Les PLC agit sur les phospholipides membranaires et plus particulièrement sur le PiP2 (Phosphatidyl Inositol biPhosphate). Cette enzyme va cliver le PiP2 en diacyl-glycérol (DAG) et Inositol TriPhosphate (IP3). Ce dernier va migrer ensuite vers le cytoplasme. Cet IP3 va agir sur les mitochondries et sur le réticulum endoplasmique qui servent de stockage au calcium. Sur le réticulum, l’IP3 se fixe sur un récepteur spécifique (récepteur canal) et l’ouvre. Le calcium va se déplacer en fonction de son gradient : donc, sort.
L’IP3 a pour rôle d’entraîner un flash de libération de calcium dans la cellule. Le DAG sert aussi de second messager car, quand il est seul, il peut activer une protéine kinase C qui va phosphoryler le plus souvent des protéines pour les rendre actives. Le PiP2 est facilement épuisable car il est en faible quantité dans la cellule.
Ces deux phénomènes (action de l’IP3 et du DAG) sont le plus souvent complémentaires.Remarque : il existe d’autres lipides qui ont des rôles importants. Celui-ci est un cas d’école !
E L’insuline et la GH (hormones hydrophiles spéciales).
L’insuline et la GH interagissent avec des protéines réceptrices plus simples, composées d’une hélice α pour la GH et d’une double hélice ß pour l’insuline.
1 Cas de la GH.
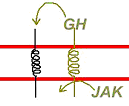
La GH arrive et se fixer, mais, pour fonctionner, il faut que le récepteur soit sous forme de dimère. Cette obligation est réglée, au niveau de la région cytoplasmique, on observe une grande affinité pour la kinase JAK qui se positionne entre les deux parties du dimère et s’active. Elle va ensuite tout phosphoryler. Ce fonctionnement est retrouvé chez les interleukines.
2 Cas de l’insuline.
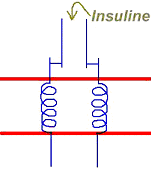
Ce récepteur à l’insuline a la particularité d’être, dans sa région intracellulaire, une enzyme qui peut phosphoryler la tyrosine (c’est une tyrosine kinase). L’arrivée de l’insuline provoque l’activation de la tyrosine kinase qui phosphoryler les tyrosines contenues dans les protéines.Le fonctionnement de ce récepteur est un cas unique.
II Les hormones lipophiles (stéroïdes sexuels et surrénaliens).
Toutes ces hormones lipophiles sont des dérivés du cholestérol.
Les glucocorticoïdes (GC).
Les glucocorticoïdes ont pour cible le noyau où ils effectuent une régulation génique. Comme le cytoplasme est hydrophile, ces GC ont besoin d’une protéine réceptrice pour le transport dans le cytoplasme et de protéines chaperons (HSP) au repos.
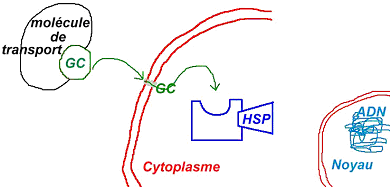
Le GC va se libérer des protéines chaperons et venir se fixer sur le récepteur. Là, il passe dans le noyau et va interagir avec l’ADN.
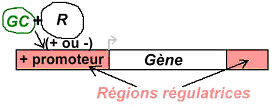
L’ensemble qui se fixe sur la région régulatrice contenant le promoteur est le SRE (Steroid Responsiv Element). La fixation a pour conséquence un contrôle de l’expression du gène, que ce soit une activation ou une inhibition.
Les glucocorticoïdes vont agir comme des facteurs de transcription.
Aucun commentaire jusqu'à présent.