BGU 03 :
Chapitre 4, la Neurohypophyse.
Télécharger le document sur le serveur FTP ou sur le serveur web (HTTP).
Généralités.
AVP = ADH = Vasopressine
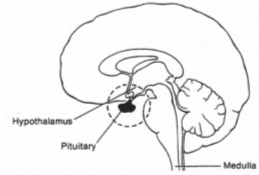
L’antéhypophyse a un rôle endocrine.
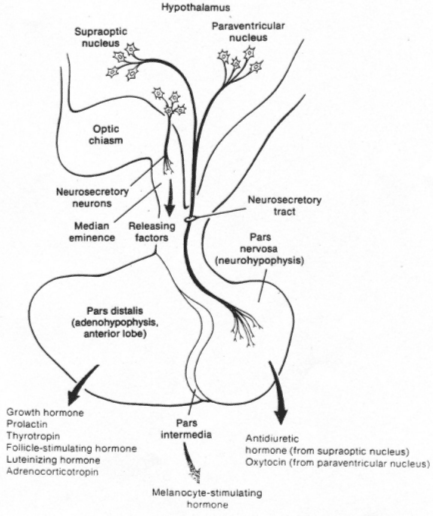
La neurohypophyse reçoit des neurones neurosécréteurs longs provenant du noyau supra optique et du noyau para ventriculaire. Cette structure reçoit du sang de l’artère hypophysaire inférieure. L’artère hypophysaire inférieure va, dans la partie supérieure, former le système porte hypothalamo-hypophysaire puis aller vers l’adénohypophyse ; elle va aussi à la neurohypophyse et en repart par la veine efférente.
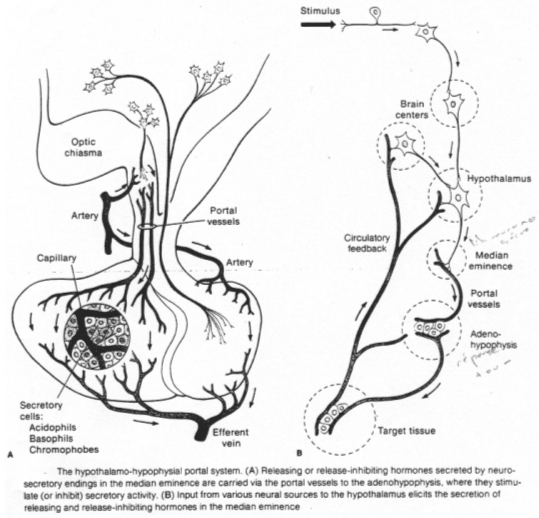
Les corps cellulaires des neurones neurosécréteurs sont situés dans les noyaux supra optique et para ventriculaire. Ils reçoivent des informations des centres supérieurs : il y a synthèse de neuropeptides selon le processus suivant :
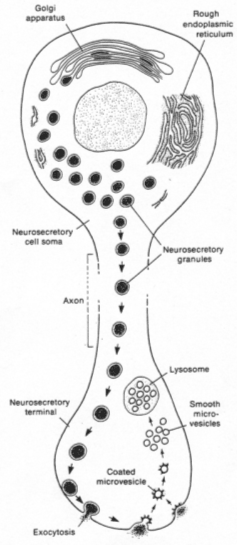
Les grains de sécrétion migrent le long de l’axone et s’accumulent dans la partie terminale.
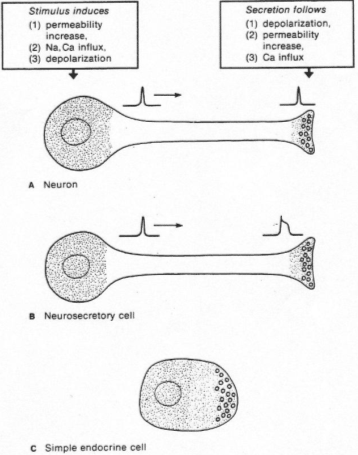
Quand le corps cellulaire reçoit l’information, la membrane plasmique est dépolarisée et donne naissance à un potentiel d’action.
Le long de l’axone, le parcours est matérialisé par une augmentation de Ca2+ libre qui favorise la contraction des fibres pour la migration des capsules.
Il y a fusion des membranes puis libération du contenu des granules.
Deux familles de peptides sont synthétisées :
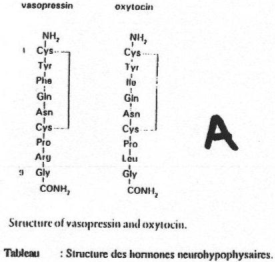
- ADH (hormone antidiurétique), formé par 9 acides aminés.
- OT (ocytocine), formé de 9 acides aminés.
Chez les mammifères, au lieu de parler d’ADH, on parle de glycine vasopressine, sauf chez le porc, on parle de lysine vasopressine. L’ADH est associée à la neurophysine 2.
L’OT a beaucoup d’analogie avec l’ADH. Cette OT est associée à la neurophysine 1. La neurophysine est constituée par une centaine d’acides aminés.
I L’ADH.
L’ADH est connue pour exercer des effets majeurs dans une cible dans le rein : le néphron (unité fonctionnelle du rein). La pression osmotique dans le cortex est égale à celle du sang (300 mOsmol). Cette pression augmente en allant de la médulla extérieure vers la médulla intérieure (de 300mOsmol à 1200mOsmol). L’existence de ce gradient osmotique est liée à l’environnement hormonal de ce tissu. On peut apprécier les pressions dans les différentes parties du néphron. Le sang, dans l’artère efférente, va irriguer le bas du néphron : la « vasa recta ». Toutes les molécules dont le poids moléculaire est inférieur à 50 000Da sont filtrées et passent à travers la barrière du néphron. Les parois des vasa recta s’équilibrent (au niveau osmotique) avec le milieu extérieur (interstitiel). Dans la branche ascendante de la anse de Henlé, il y a imperméabilité à l’eau. L’existence de ces proportions et la capacité de créer à tous les niveaux une pression de 200mOsmol permet l’obtention d’un liquide (urine) hypotonique par rapport au liquide interstitiel.

- Au stade I, le tube est vide puis se remplie d’une solution isotonique au plasma (300mOsmol).
- Au stade II, on observe une pression de 200mOsmol.
- Au stade III, on réinjecte de la solution à 200mOsmol.
- Au stade IV, l’équilibre est atteint.
- Au stade V, on ajoute du liquide à 300mOsmol.
- Au stade VI, l’équilibre est atteint et ainsi de suite.
- L’expérience se termine quand on atteint 1200mOsmol.
- Si l’on n’a plus d’ADH, le gradient chute.
- Dans ce cas, l’ADH n’affecte pas les mouvements d’eau dans la anse ascendante de Henlé. Dans le tube collecteur de Bellini, l’ADH augmente la réabsorption d’eau.
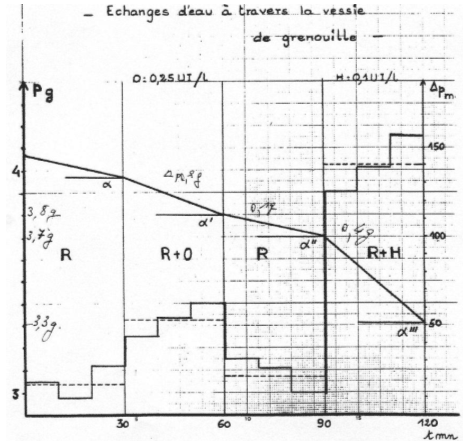
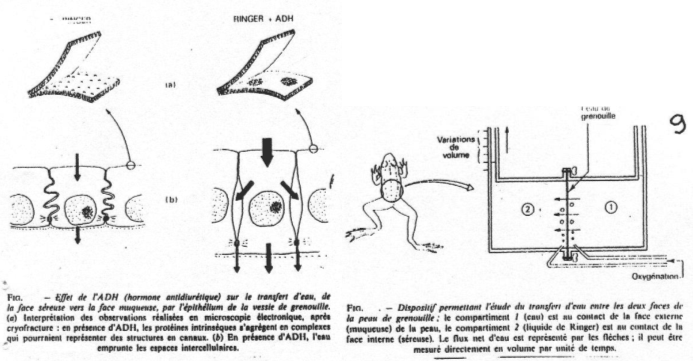
Dans le cas des cellules épithéliales de grenouille, la membrane du coté de la lumière de la vessie est une muqueuse ; la membrane du coté opposé est une séreuse. Les transferts se font de la muqueuse vers la séreuse.
On plante un cathéter dans la vessie disséquée d’une grenouille, on la remplie de ringer puis on la place en suspension dans le même liquide. Quand on ajoute un analogue à l’ADH, on observe une diminution du poids de la vessie.
En cryogénie, la membrane épithéliale présente des canaux à eau (sous l’action d’ADH) : les aquaporynes. L’ADH est reconnue par un récepteur membranaire (V2). Quand elle se lie, on peut observer l’augmentation de l’activité de l’adénylate cyclase, grâce à une protéine-G.
Cet accroissement d’activité donne la forme d’AMPc à cause de la phosphorylation de protéines qui permettent de transloquer les aquaporynes vers la membrane et de les y insérer.
L’ADH participe :
- à l’établissement cortico-papillaire ;
- à la mise en jeu des transferts d’eau (au niveau du tube contourné proximal, de l’anse descendante de Henlé et du tube collecteur de Bellini).
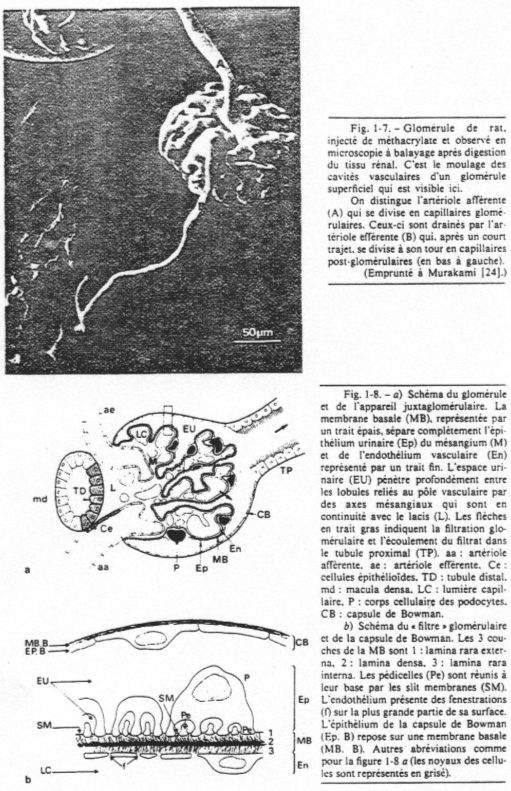
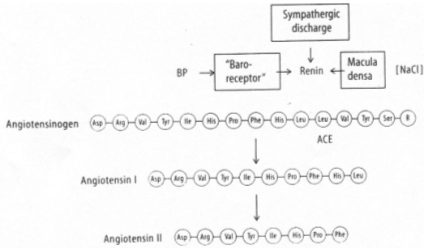
Au niveau du tube contourné distal, les cellules de la macula densa sont sensibles à la teneur en sodium dans la lumière du tube contourné distal.
Au niveau de l’artériole afférente, on trouve les cellules sécrétrices de rénine qui sont au contact de l’endothélium de ce canal.
A Régulation de sécrétion de l’ADH.
Si on réalise le branchement d’un cathéter sur la carotide d’un mammifère et qu’on lui injecte une solution hypertonique, il y aura une variation de moins de 2% grâce à la libération d’ADH qui permettra de compenser le manque d’eau.
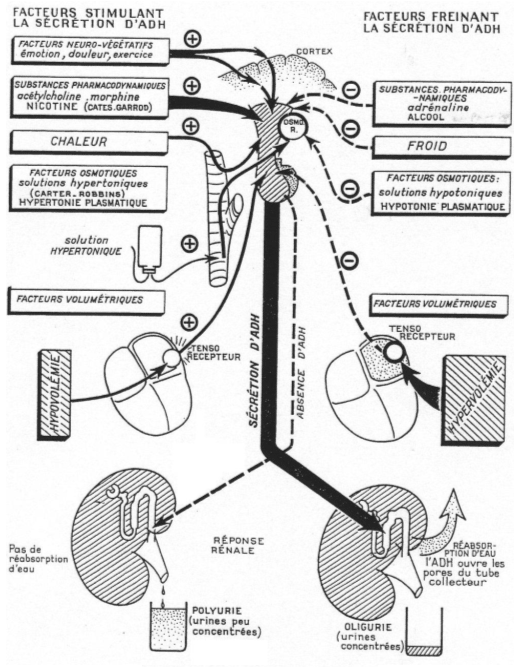
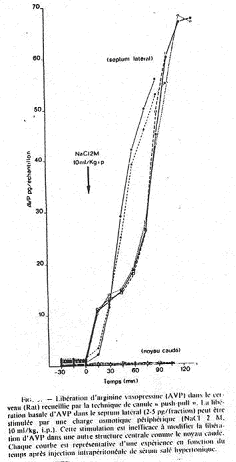
De –30’ à 0’, c’est l’enregistrement des références. De 0’ à 30’, le noyau caudé entraîne une libération d’ADH constante alors que le septum latéral réalise une importante libération d’ADH.
Au voisinage les neurones para ventriculaires, supra optiques et d’autres structures neuronales (osmorécepteurs), captent l’osmolarité : ce sont des neurones à ADH.
1 Les facteurs volumétriques (volume sanguin).
Voir schéma plus haut.
- S’il y a hypervolémie, celle-ci est perçue par la paroi de l’oreillette gauche ; ces informations remontent par des fibres sensitives et vont être intégrées puis répercutées vers les deux noyaux concernés pour un arrêt de la libération d’ADH.
- Une hypovolémie entraîne une accélération de la sécrétion d’ADH.
2 La température.
Une augmentation de la température externe entraînera une augmentation de la production d’ADH alors qu’une diminution de la température provoquera un blocage de la synthèse d’ADH.
3 Morphine et nicotine.
Une augmentation de la concentration en morphine et nicotine provoque un accroissement de la synthèse d’ADH.
4 L’alcool.
L’alcool va inhiber la production d’ADH.
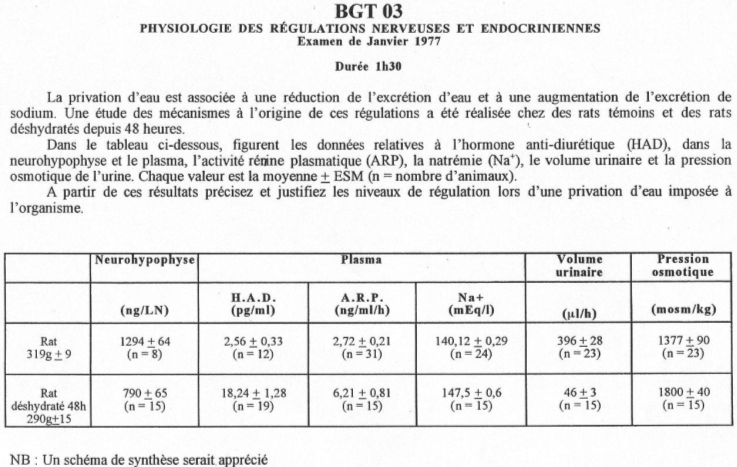
L’excrétion de sodium permet de réguler sa concentration à l’intérieur de l’organisme pour ne pas créer d’excès.
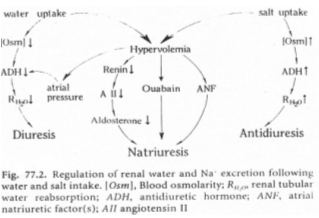
Une hypervolémie peut être induite par : une forte quantité de sel ou par une absorption d’eau élevée.
L’hyperosmolarité due au sel va être perçue :
- Au niveau central par des osmorécepteurs situés près des neurones à neurohormones. Il y a alors, au niveau de la neurohypophyse, libération d’ADH. Cette hormone, au niveau rénal, favorise la réabsorption d’eau (tube contourné distal, tube collecteur de Bellini) : on parle d’antidiurèse.
- Au niveau des oreillettes, par des cellules sécrétant l’ANF (Facteur Natriurétique Atrial) qui est polypeptides de 28 acides aminés. Cet ANF a un rôle important pour l’homéostasie liquidienne, en favorisant la natriurèse (effet sur le tube contourné distal) : diminution de la réabsorption de sodium (remarque : l’aldostérone favorise l’absorption de sodium).
L’hypervolémie due à une forte absorption d’eau peut être perçue :
Par des volorécepteurs situés au niveau de l’oreillette gauche qui informent le système nerveux central via des fibres empruntant la voie vagale. En retour, il y a un effet au niveau des cellules à rénine qui en réduisent la sécrétion. On observe donc : une diminution de rénine circulante, puis, une diminution d’angiotensine 1 qui entraîne la diminution d’angiotensine 2.
Cette dernière diminution, au niveau de la zone glomérulée provoque un manque d’aldostérone arrivant au tube contourné distal. Il y a donc, chute de la réabsorption de sodium et de la natriurèse facilitée. La diminution de l’osmolarité du milieu interne lors de l’absorption d’eau provoque une chute de l’AVP libérée donc, une diminution de l’eau réabsorbée : Diurèse.
Chez certains modèles animaux, des pathologies se manifestent par des pertes d’eau importantes : on parle de « diabète insipide ». Cette maladie résulte d’une altération de la neurohypophyse.
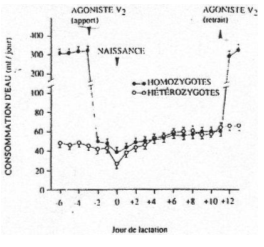
Le travail est réalisé sur des femelles homozygotes (atteintes) et sur hétérozygotes (« normales »). La consommation d’eau est plus élevée chez les homozygotes avant la lactation.
Deux jours avant la naissance, on ajoute dans les deux lots la molécule « agoniste V2 » et ce, jusqu’au 10ème jour.
L’agoniste, chez les homozygotes, entraîne la diminution de la prise d’eau jusqu’à des valeurs caractéristiques des hétérozygotes. Après dix jours, sans agoniste, la prise d’eau des homozygotes revient à ses valeurs du début.
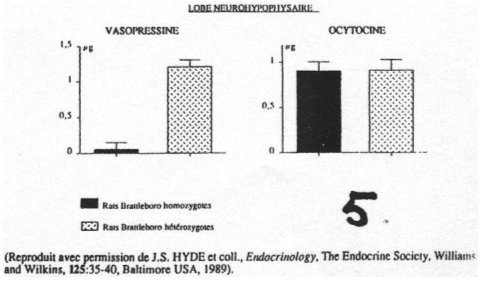
On observe une absence de synthèse d’ADH au niveau des noyaux para-ventriculaire et supra optique.L’AVP a une action sur les fibres musculaires lisses autour des artérioles : effet contracturant qui participe à l’hypertension.
Dans le foie, le glucose est stocké sous forme de glycogène. L’AVP va se fixer sur des récepteurs membranaires de l’hépatocyte : les récepteurs V1 (à ADH) et forment un complexe hormone-récepteur qui va activer une enzyme membranaire (la phospholipase C ou PLC) par l’intermédiaire d’une protéine « G ».
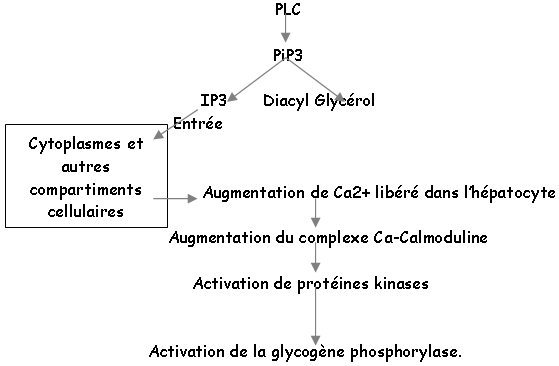
Le glycogène va être fragmenté en glucose1P, transformé en glucose6P par une isomérase qui aboutit au glucose grâce à la glucose-6-phosphatase.
Il y a une autre action extra-rénale.
Au niveau central, il existe des neurones mettant l’AVP en jeu comme un neurotransmetteur (chez les axones courts se terminant vers l’éminence médiane). Dans les situations de stress, il y a accroissement de la densité en ADH. L’ADH peut passer dans le système porte de l’adénohypophyse où elle joue le rôle de libérine en stimulant les cellules synthétisant le cortisol. Ce dernier est hyperglycémiant car il augmente la néoglucogenèse hépatique (à partir d’acides aminés glucoformateurs et de glycérol).
L’excédant de glucose venant de la néoglucogenèse peut être stocké en glycogène.
II L’ocytocine.
Le complexe neurophysine-ocytocine est libéré et va :
- Stimuler les muscles utérins pour faciliter le passage des spermatozoïdes.
- Exercer une activité contractile sur le muscle utérin au moment de la naissance.
- Exercer un effet sur les fibres lisses des canaux galactophores afin d’éjecter le lait dans la gueule du jeune.
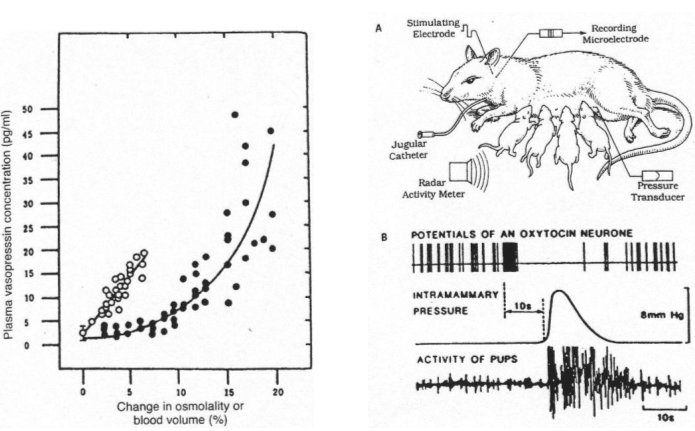
On a une rate équipée d’une micro électrode captant les signaux parvenant des zones para ventriculaire ou supra optique ainsi qu’une autre micro électrode pour la stimulation.
On lui place aussi un cathéter dans la jugulaire pour réaliser des injections.
Sur la partie du bas, on a représenté l’activité des petits.
La succion du mamelon (pression intramammaire) provoque une activité électrique sur un neurone à ocytocine.
Cette expérience est complétée par un enregistrement de corps cellulaires de neurones à ocytocine.
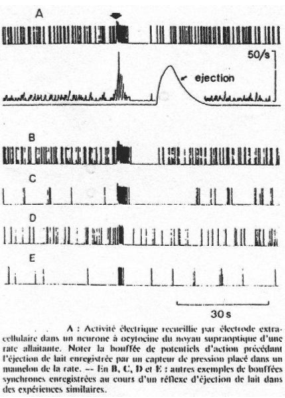
Il y a une très forte augmentation du nombre de spikes avant l’éjection du lait.
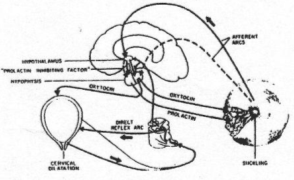
Au niveau du mamelon, on trouve des récepteurs à la pression. Ils informent le système nerveux central par des fibres nerveuses sensorielles. En retour, il y a une réponse par activation des neurones à ocytocine (noyaux supra optique et para ventriculaire). Il y a donc libération d’ocytocine dans la veine sortant de l’hypophyse. L’ocytocine arrive aux glandes mammaires et stimule les muscles (fibres musculaires lisses) pour provoquer l’éjection du lait : c’est exemple de réflexe neurohumoral.
Remarque : la prolactine favorise la synthèse de lait.
Dans la paroi musculaire utérine, au niveau du col vaginal et du cervix, existent des récepteurs sensibles à la pression. Ces derniers envoient des potentiels d’action qui empruntent la voie sensitive par l’intermédiaire de la moelle épinière (voie spino-thallamique) pour arriver dans le mésencéphale qui touche les neurones à ocytocine.
Cette hormone, par voie sanguine, arrive au niveau du myomètre où les fibres musculaires lisses se contractent. Chez les mammifères, ce réflexe neurohumoral est déterminant pour la mise-bas. Au terme de la gestation, le fœtus exerce une pression importante au niveau du cervix et entraîne le départ du message (potentiels d’action des récepteurs à la pression). A chaque pression, on a en retour de l’ocytocine qui va faire se contracter le muscle utérin qui permet donc, une plus forte pression du fœtus : la fréquence de contractions s’accroît au fur et à mesure du temps.
Remarque : il a été montré dans les accidents où l’hypothalamus et l’hypophyse se dissocient qu’il est possible de sauver l’enfant mais qu’un accouchement normal est impossible car il n’y a plus d’ocytocine. Les récepteurs utérins à l’ocytocine sont sous la dépendance de la progestérone (effet inhibiteur). Dans la circulation sanguine, pendant la grossesse, il existe une enzyme (une tyrosinase) qui hydrolyse la liaison cystine-tyrosine de l’ocytocine et la rend ainsi inactive.
Aucun commentaire jusqu'à présent.