Biologie du Développement :
Chapitre 4 :
Phénomènes mophogénétiques de la régulation.
Télécharger le document sur le serveur FTP ou sur le serveur web (HTTP).
Au cours du développement d’un œuf totipotent, on assiste à une détermination progressive de divers ensembles cellulaires qui aboutissent par pertes successives de potentialité à la différenciation cellulaire terminale. Cette détermination, se faisant par interactions cellulaires, est régulée au cours des différentes étapes du développement. Cette régulation permet, en contrepartie, une grande flexibilité, les cellules n’étant pas d’emblée prédéterminées.
I Capacités de régulation chez les amphibiens.
Expériences réalisées par Spemann et >Mangold en 1927.
Dès que les territoires présomptifs commencent à se déterminer, les phénomènes de régulation intéressent des ensembles cellulaires de plus en plus réduits appelés champs morphogénétiques.
A Expérience fondamentale de Spemann.
Cette expérience consiste à réaliser la greffe de la lèvre dorsale du blastopore d’une jeune gastrula à partir de deux germes différemment pigmentés ; à partir d’un œuf de triton crêté (œufs clairs) et d’un œuf de triton vulgaire (œufs sombres).
Ce marquage est nécessaire pour retrouver dans le germe hôte : les tissus provenant du greffon.
On prélève la lèvre dorsale du blastopore d’une jeune gastrula de triton crêté et on la greffe sur la face ventrale d’une autre jeune gastrula, au même stade, de triton vulgaire, à la place d’un volet d’ectoblaste de même dimension et préalablement excisé, le greffon est alors implanté en position inversée (les deux concavités se faisant face de part et d’autre du pôle végétatif). Ceci est nécessaire pour que l’invagination au niveau du greffon conduise à un résultat à long terme.
L’enroulement de la gastrulation se fait dans le même sens que les mouvements d’épibolie de l’ectoblaste du porte-greffe. La gastrulation du germe hôte se poursuit normalement de son côté. Au moment de la neurulation, apparaît une plaque neurale secondaire. Ces deux plaques évoluent pour leur propre compte et constituent chacune un tube nerveux. Ainsi, un embryon, primaire, se forme et ventralement, un deuxième embryon, légèrement plus petit que le primaire, se développe normalement constitué.
h3>B Analyse des résultats.
Le greffon s’est invaginé autour de la lèvre blastoporale et ses cellules ont formé la chorde antérieure et une partie des somites de l’embryon secondaire. Ce greffon s’est développé dans sa nouvelle situation conformément à sa destinée. Ce greffon est capable de s’auto-différencier : il était déterminé au moment où on l’a prélevé. Il ne s’est pas transformé en épiderme dans sa nouvelle position. Par contre, les deux territoires présomptifs de l’ectoblaste, au début de la gastrulation, étaient encore indéterminés.
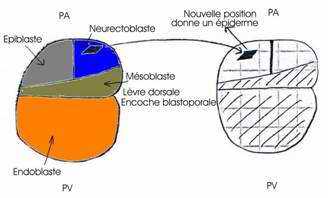
Les deux territoires, épiblaste et neurectoblaste, sont indéterminés au moment de leur prélèvement. L’épiblaste présomptif est compétent pour recevoir l’induction neurogène. Les différents territoires d’un même stade embryonnaire n’ont pas le même degré de détermination (lèvre dorsale, neuroblaste et épiblaste présomptifs).
- Au contact des tissus invaginés du greffon, l’épiblaste ventral présomptif du porte-greffe s’est transformé en neuroblaste et a fourni la totalité du système nerveux de l’embryon secondaire, au lieu de se différencier en épiderme. Le greffon a donc exercé une action inductrice sur l’ectoblaste ventral du porte-greffe. Le système nerveux secondaire est le résultat d’une induction neurogène exercée par le greffon sur l’ectoblaste encore indéterminé du porte-greffe. Les cellules nerveuses proviennent par conséquent du porte-greffe et non du greffon. Cela signifie que l’ectoblaste ventral est compétent pour recevoir l’induction neurogène.
- Le greffon a exercé d’autres effets inducteurs sur les feuillets du porte-greffe. Le mésoblaste latéral du porte-greffe aurait du fournir les dérivés de la splanchnopleure et de la somatopleure. Sous l’influence du greffon, il a fourni la chorde du tronc et de la queue et une partie des somites ainsi que le pronéphros. Le greffon a donc transformé les potentialités du mésoblaste latéral en exerçant sur celui-ci une induction mésoblastogène ou mésodermatisante. Le mésoblaste latéral présomptif se transforme en mésoblaste cordal et somatique.
Conclusion :
L’embryon induit n’est pas formé de tissus déposés de façon anarchique. C’est un organisme (centre organisateur) donné à la lèvre dorsale du blastopore. Ce centre organisateur occupe le centre du croissant gris sur l’œuf de grenouille asegmenté au début de la gastrulation puis les territoires présomptifs de la plaque précordale, corde, somites antérieures et endoblaste pharyngien.
II Les oiseaux.

La blastula secondaire de Cane donne >Lutz.
III Les mammifères.
Le cas des jumeaux homozygotes (cf. p 5 sur les mammifères).
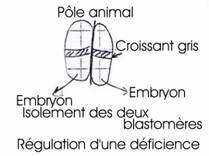
- Tarkovski (1961) : au stade de deux blastomères, il les a séparés et a obtenu une souris normale : régulation de la déficience.
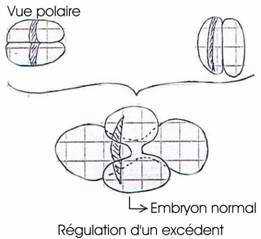
- Mintz (1962) : fusion de deux morulas de souris de couleur différente : on obtient un blastocyste géant, implantable dans l’utérus. On aura alors une souris normale chimère. Elle aura quatre parents, les génomes de ses parents s’exprimant en même temps. Il y a toutefois régulation d’un excédent.
- Hillman (1972) : il a utilisé une morula de souris marquée à la thymidinen tritiée. Il dissocia les cellules de cette morula, qu’il incorpore à l’intérieure d’une morula receveuse. Les cellules forment les boutons embryonnaires lorsqu’elles sont injectées à la surface d’une morula : formation du trophoblaste. Les cellules sont encore totipotentes : il y a eu un effet de position, des signaux extrinsèques vont modifier leur destinée par des interactions cellulaires et des facteurs vont ainsi se transmettre et définir un patron de détermination. Ces capacités de régulation contrastent avec les embryons mosaïques.
IV Les embryons mosaïques.
A Le développement de l’œuf d’une ascidie.
Ces ascidies sont des animaux marins (groupe le plus important des urocordés à corde dorsale dans la queue).
L’apparition de la corde en position dorsale est fondamentale car cet axe longitudinal de soutien marque l’avènement du système nerveux en position dorsale (invertébrés à ventral).
Les larves ont l’aspect d’un têtard avec la corde uniquement au niveau de la queue. Au cours de la métamorphose, elles perdent la queue et donc la corde ; l’adulte se fixe à un substrat. Le corps de cet adulte est recouvert d’une tunique, d’où le nom de tunicier.
L’ovocyte primaire possède une couche périphérique pigmentée en jaune, un cytoplasme gris ardoisé comprenant des plaquettes vitellines et un cytoplasme hyalin autour du noyau.
La fécondation entraîne des remaniements cytoplasmiques : apparition des trois régions.
- cytoplasme hyalin (équatorial),
- cytoplasme gris (PA),
- cytoplasme jaune (PV).
Le spermatozoïde, en pénétrant par le PV, et en remontant vers le centre de l’œuf, va provoquer de nouveaux déplacements cytoplasmiques. La fusion des deux pronucléus a lieu à mi-chemin entre le centre de l’œuf et le PV. Ces déplacements aboutissent à la formation de six territoires visibles disposés dans un ordre précis par rapport à l’axe de l’œuf. C’est une disposition qui préfigure le plan de symétrie bilatérale de la larve.
On peut distinguer, dans l’hémisphère animal, une large calotte de cytoplasme hyalin clair ou ectoplasme qui donnera l’ectoderme. Du futur côté antérieur de l’embryon, un croissant gris clair granuleux, dont une partie, située à l’équateur et l’autre au-dessous, constituent le neuroplasme et le cordoplasme qui donneront le système nerveux et la corde. Du côté opposé, se trouve un croissant jaune, lui-même formé d’un croissant jaune foncé constituant le mésoplasme caudal, qui donnera le mésoderme caudal. En dessous, un croissant jaune clair formera le mésoplasme thoracique et donnera le mésoderme thoracique. Au PV, un cytoplasme gris ardoisé constituera l’endoplasme et donnera l’endoderme. On a alors six territoires cytoplasmiques déterminés.
Chacune de ces régions constitue un marqueur naturel des cellules dont on peut suivre la destinée. Ces régions traduisent l’anisotropie du cytoplasme et peuvent être considérées comme des plasmes organogènes dont la destinée est rigoureusement déterminée.
Le premier plan de segmentation est méridien et coïncide avec le plan de symétrie bilatérale. Au stade deux blastomères, chacun des blastomères contient les six territoires. Le deuxième plan de segmentation est méridien, perpendiculaire au premier et va séparer les deux blastomères postérieurs renfermant le croissant jaune et les deux blastomères antérieurs renfermant le croissant gris. Le troisième plan de segmentation est subéquatorial et donne huit blastomères :
- 4 blastocystes animaux contenant l’ectoplasme qui donnera l’ectoderme,
- 4 blastocystes végétatifs, dont les deux postérieurs contenant le croissant jaune, le mésoplasme caudal et thoracique donnant les mésodermes respectifs. Les deux antérieurs contiennent le croissant gris, le neuroplasme et le cordoplasme.
Grâce à ces marqueurs colorés, on peut faire une analyse expérimentale.
B Analyses expérimentales.
Chatry (1887) et Cowklin (1905).
C’est une étude de la conséquence de la destruction sélective des blastomères ou de l’isolement de certains d’entre eux.
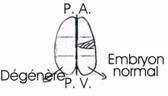
Si on sépare les deux premiers blastomères, situés de part et d’autre du plan de symétrie bilatérale ou si l’on détruit l’un d’eux, on obtient le développement d’un hémi-embryon gauche ou droit.
Si, au stade 4 blastomères, on détruit les deux blastomères postérieurs (ou si on les sépare), on obtient un hémi-embryon antérieure avec une structure dorsale (ectoderme, plaque neurale avec organes sensoriels) mais on n’a pas de structure ventrale (musculature ou endoderme). Ultérieurement, à 32 blastomères, la destruction de chacun des blastomères est suivie de l’absence des organes correspondants (corde, mésoderme et système nerveux).
Conclusion : Chaque territoire cytoplasmique est un plasma organogène. Isolé, il ne peut s’auto-différencier ; détruit, il ne peut être remplacé.
Aucun commentaire jusqu'à présent.