Biologie Moléculaire :
Chapitre 3 : La régulation de la transcription.
La transcription est initiée en « +1 » car en amont, le promoteur est reconnu est c’est là où viennent s’installer des complexes d’initiation.
Pour réaliser cette transcription, une cellule va passer par diverses étapes.
La cellule reçoit des informations qui vont entraîner une régulation du génome et donner un système différencié.
Les informations du milieu extérieur vont être intégrées et donner des réponses adaptatives.
On trouve en nombre variable deux séquences portées par l’ADN, situées de part et d’autre du « point +1 » (surtout en amont ce point) : ce sont des séquences de régulation. On a des boites intriquées qui permettent la compétition des divers facteurs de régulation (+ ou -).
Télécharger le document sur le serveur FTP ou sur le serveur web (HTTP).
I Gènes dont la régulation est cycle cellulaire dépendante.
A Les gènes hormono-régulés.
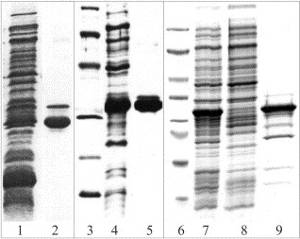
Les cellules en arrêt de croissance (en phase G0), lorsqu’elles sont stimulées vont mettre en place un programme d’expression génique. Les stimulations peuvent être :
- du sérum,
- des facteurs de croissance (autocrine ou paracrine) : ces derniers sont indispensables mais ils peuvent être cancérigènes.
Le programme d’expression génique va entraîner une transcription précoce ou tardive.
Ces facteurs de croissance permettent de synchroniser une population cellulaire.
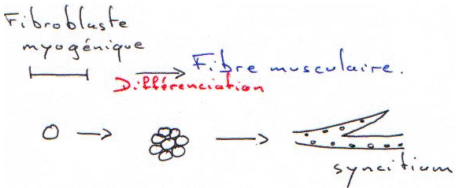
Les hormones stéroïdes reconnaissent des récepteurs intracellulaires. (cf. cours d’endocrinologie).
B Stratégie d’étude ; étude par transfection.
1 Cas généraux.
Dans une cellule eucaryote, on fait entrer des plasmides ou des rétrovirus (infection).
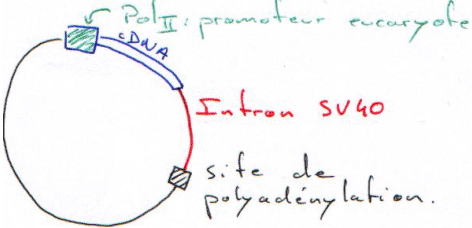
Pour être transcrit, le plasmide doit pouvoir utiliser la machinerie de la cellule hôte.
Les promoteurs (eucaryotes) utilisés peuvent être :
- Fort : haute fréquence d’initiation. Ce sont des promoteurs viraux, de RSV-, CMV (cytomégalovirus), SV40 (virus à ADN qui infecte le singe).
- Faible : faible fréquence d’initiation. Tk, Proliférine.
Le promoteur est choisi en fonction de l’étude que l’on veut faire.
On peut faire fabriquer à des cellules eucaryotes, des produits bactériens (protéines d’intérêt).
Quand les gènes eucaryotes sont transcrits, ils donnent un pré-messager (un chacun) (quand il est transcrit par la polymérase II). Ce dernier est reconnu comme pré-messager et va subir une maturation. Ce messager est ensuite dirigé vers le cytoplasme pour permettre la synthèse de protéine.
Il y a une relation entre la quantité de protéines produites et la quantité de transcription.
2 Transfections réalisées.
2.1 Transfection transitoire.
La cellule après la transcription, est utilisée dans un temps très court pour éviter l’intégration.
On utilise ce système pour étudier la régulation des promoteurs.
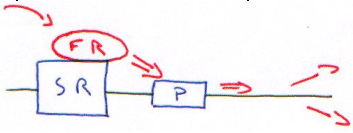
Le cDNA code pour un gène rapporteur (protéine facilement repérable, de procaryotes). On trouve :
- CAT : Chloramphénicol Acétyl Transférase (La CAT transforme le chloramphénicol en forme inactive).
- β-galactosidase.
- uciférase.
On réalise un broyat cellulaire auquel on ajoute de l’acétate (sous forme d’ACo A) et du chloramphénicol. Si ce dernier est acétylé, c’est que l’enzyme est présente.
Une cellule eucaryote peut intégrer 1 à 50 plasmides. Attention, deux populations cellulaires peuvent intégrer un nombre différent de plasmides (le volume de synthèse sera différent). On ajoute donc un plasmide de contrôle ou un gène constitutif non régulé (comme la β-gal) dans le plasmide.
Pour obtenir le standard interne, on fait le rapport : Activité CAT/Activité ![]() -gal.
-gal.
Au bout d’un moment (72 heures), tous les plasmides non intégrés vont être dégradés. Il faut attendre entre 24 et 48 heures pour que le plasmide s’installe.
On a donc entre 1 et 2 jours pour travailler.
2.2 Transfections stables.
Il y a introduction définitive d’un gène (plasmide) dans le génome.
La fréquence de réussite est de 10-5 à 10-6.
Pour crible positif, on ajoute sur le plasmide, un gène de résistance à la néomycine (G418) et on réalise les cultures en présence de l’antibiotique spécifique.
3 Les séquences reconnues par les récepteurs.
Ces séquences sont des séquences bipartites.

Ces séquences présentent des homologies (en rouge).
Sous forme de dimère, le récepteur reconnaît la séquence et selon celle-ci, il répresse ou active.

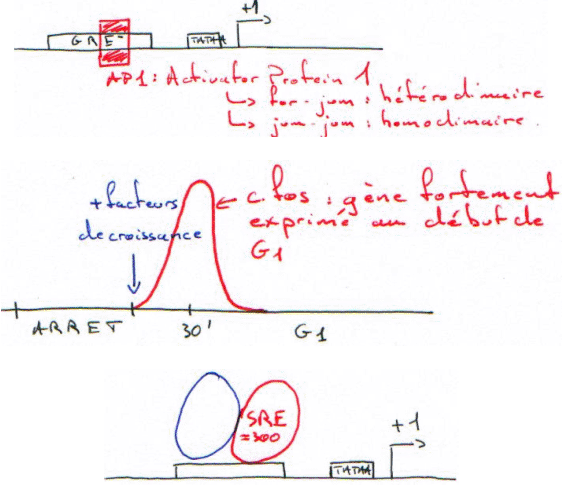
Les gènes responsables de la transformation des cellules sont des oncogènes : si le gène est (trop) stimulé, on arrive au stade de cellule cancéreuse.
A chaque oncogène viral (V-Fos) correspond un gène chez les mammifères : les proto-oncogènes (C-Fos). Ces derniers sont les gènes assurant la régulation du cycle et les effecteurs (réplication et transcription).
Exemple de la protéine Sarc :
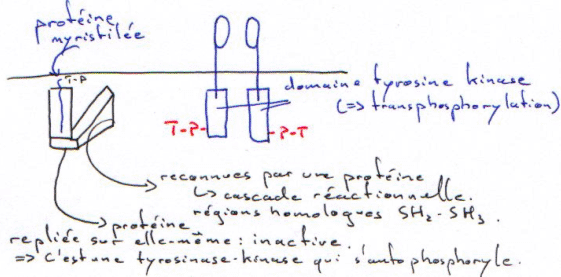
Quand le Tyr-P (T-P sur le schéma) du dimère vient sur la protéine myristilée, il y a ouverture de l’enzyme et activation de celle-ci. Une mutation ponctuelle peut entraîner la forme virale, toujours ouverte.
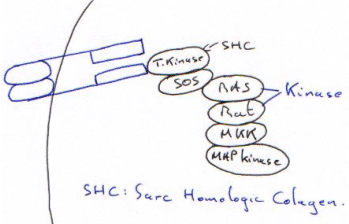
La MAP-Kinase va phosphoryler ce qui est sur SRE (avant la tata box). Dès que le ligand se fixe, il y a endocytose du complexe –> c’est une période réfractaire.
C’est l’activation transitoire de la kinase.
D’une façon générale, la kinase et la phosphatase sont associées au site de phosphorylation. A t=x, si la phosphatase est plus active que la kinase, on obtient une protéine de phosphorylation (l’inverse est vrai).
Dans le noyau, une phosphatase est constitutive par un jeu de phosphorylation par la déphosphatase. On peut expliquer l’activation de C-Fos.
Remarque : L’activation de C-Fos est quasi immédiate. Ce système évite de synthétiser de nouvelles molécules. Il n’y a qu’à phosphoryler les protéines constitutives pour les activer. C’est l’étape précoce.
Il y a ensuite synthèse d’AP1 qui va stimuler tous les gènes qui le reconnaissent. ? C’est l’étape tardive de synthèse.
Il y a un point R (de restriction) entre les deux phases (précoce/tardive). Le passage de ce point permet la prolifération.
Aucun commentaire jusqu'à présent.