BGU 03 :
Chapitre 5, L’insuline (le pancréas endocrine).
Télécharger le document sur le serveur FTP ou sur le serveur web (HTTP).
I. Généralités.
Le pancréas a une double fonction : endocrine et exocrine.
L’activité exocrine est liée à la présence de tissus constitués d’ascini pancréatiques qui déversent leurs produits de sécrétions dans les canaux pancréatiques puis dans la lumière intestinale. Le canal cholédoque permet de relier le foie à l’intestin. Au départ de ce canal, le liquide est verdâtre mais si l’on réalise une ligature près du foie, on obtient un liquide transparent : le liquide pancréatique.
II. Historique.
Vers 1870, langerhans a constaté qu’il y avait un motif répétitif avec quelques structures disséminées : les îlots.
Vers 1900, on a constaté qu’après une pancréatectomie, le glucose urinaire et sanguin augmentait. Une greffe de pancréas sur une carotide de chien permettait de ne plus avoir d’hyperglycémie : il y a donc dans le pancréas, un produit qui est capable de réguler la glycémie. On a observé qu’une ligature du pancréas entraînait la mort des ascini et montrait qu’il ne restait que les îlots.
On observe deux types de diabète :
- un manque d’insuline,
- une perte de la fonction de synthèse d’insuline due à l’âge qui peut être traitée par des médicaments (stimulation des îlots de langerhans).
Pendant la seconde guerre mondiale, on constatait que sur certains patients, les cellules produisant l’insuline étaient nécrosées. L’aloxane produite par écrasement musculaire provoquait la mort des cellules à insuline mais il restait un type cellulaire : les cellules α (ou A), à glucagon.
L’immunofluorescence a permis de mettre en évidence de nouveaux produits : la somatostatine (produite par les cellules D et qui exerce un rétrocontrôle négatif sur les cellules α et ß) et un polypeptide pancréatique (qui intervient dans les situations extrêmes en favorisant l’hyperglycémie).
III. Physiologie.
A. Les cellules ß des îlots de langerhans.
Ces cellules ß vont synthétiser trois chaînes polypeptidiques (A, B, C). Les chaînes A (21 acides aminés) et B (30 acides aminés) sont reliées entre elles par deux ponts disulfures : cyst7A – cyst7B et cyst20A – cyst19B. La chaîne est auto reliée entre cyst6A et cyst11A.
La synthèse protéique a lieu dans le réticulum endoplasmique et le produit est la pro-insuline. Elle passe dans l’appareil de Golgi où elle est enrobée d’une membrane : ce sont des granules qui contiennent donc la pro-insuline (les trois chaînes) mais aussi des enzymes protéolytiques qui vont dégrader la pro-insuline en insuline + peptide C. Ces granules migrent vers la membrane et sont libérés par exocytose dans le courant circulatoire. Finalement, sont libérés : 94% d’insuline et de peptide C et 6% de pro-insuline.
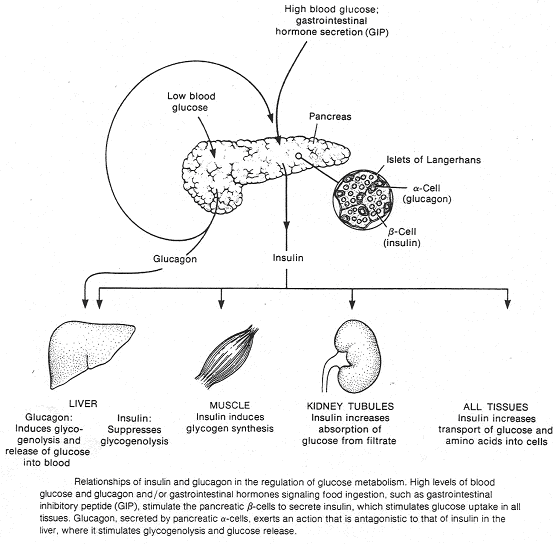
Les cellules α (à glucagon) sont à l’extérieur, les cellules ß sont à l’intérieur. Les cellules γ synthétisent la somatostatine qui va avoir un effet inhibiteur sur le glucagon et l’insuline. Le sang est récupéré par une veine efférente, passe dans une veine porte et va au foie.
B. La régulation au niveau nerveux.
– Au niveau de la glycémie : à l’occasion de chaque prise alimentaire, on observe une légère augmentation du taux de glucose dans le sang (5mM à 6,5mM).
– Un pic d’insulinémie est présent en même temps que l’accroissement du taux de glucose.
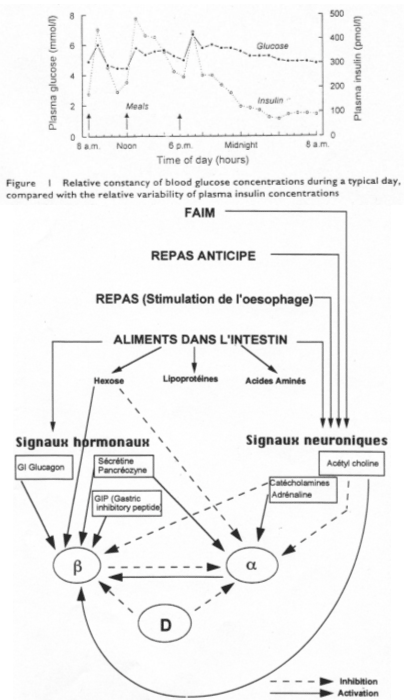
On imagine, après un jeune physiologique, une sensation de faim intégrée au niveau central.
Il y a une double innervation de l’îlot : le système parasympathique (par les fibres du nerf vague, venant du noyau de l’hypothalamus latéral). Le neurotransmetteur est l’acétylcholine (avec un relais au niveau d’un ganglion parasympathique). L’acétylcholine va réagir avec un récepteur membranaire (muscarinique) et entraîner la libération d’insuline.
Au niveau de l’étage hypothalamique, on a un noyau important : le VMH qui est impliqué dans le phénomène de satiété. L’information part du VMH, passe par le nerf splanchnique, libère de l’acétylcholine comme premier neurotransmetteur, passe un ganglion mésentérique supérieur et termine son cheminement par une fibre orthosympathique qui libère de la noradrénaline comme dernier neurotransmetteur (et se fixe sur les récepteurs α2). Il y a dans ce cas, inhibition de la synthèse et de la libération d’insuline.>
Pendant le repas, on trouve une activité du système parasympathique alors que c’est le système nerveux orthosympathique qui est prédominant durant un jeune. La sensation de faim est intégrée au niveau central et accentue la libération d’insuline précoce pour favoriser l’absence du pic de glucose. Un « repas anticipé » va renforcer le pic d’insuline.
Dans la bouche, autour de la langue, on trouve des récepteurs au glucose qui, lorsqu’ils sont stimulés, vont renforcer la libération d’insuline. Au niveau duodénal, on trouve aussi des cellules sensibles au glucose qui le même effet que les précédentes quand elles sont stimulées.
Quand l’absorption de glucose démarre, il y a activation de cellules endocrines de l’épithélium intestinal. Il y a synthèse de GIP qui freine la sécrétion de suc gastrique par voie sanguine, au niveau des îlots, grâce à un récepteur au GIP qui permet une forte stimulation de la synthèse et la libération d’insuline. Avant l’absorption, les sécrétions intestinales vont stimuler les cellules ß. L’activité du système orthosympathique est faible : finalement, il y a forte synthèse et libération d’insuline. Pendant l’absorption, l’augmentation de glucose entraîne une hyperglycémie qui va être perçue au niveau des îlots de Langerhans.
C. La régulation au niveau moléculaire.
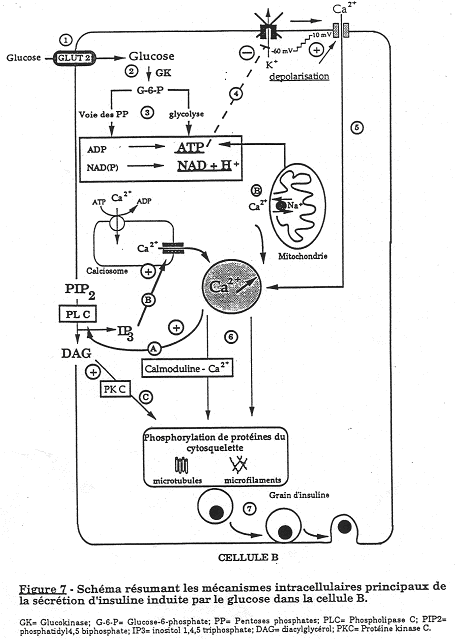
Le glucose, sur la membrane plasmique de la cellule ß, pénètre facilement dans la cellule grâce à l’action d’une protéine favorisant l’entrée de ce sucre (transporteur de Glucose : Glut-2). Ce glucose va être phosphorylé par une glucokinase (GK). Le G6P produit est engagé dans deux voies de métabolisme importantes :
- La voie des pentoses phosphates.
- La voie de la glycolyse.
Les résultats des ces voies métaboliques se traduisent par une élévation d’ATP intracellulaire. Ce taux d’ATP inhibe alors les canaux K-ATP dépendants situés au niveau de la membrane de la cellule ß
La fermeture de ces canaux est accompagnée d’une dépolarisation des cellules ß qui permet l’ouverture de canaux Ca2+. Le calcium intracellulaire va augmenter et se fixer sur la calmoduline pour former un complexe provoquant la phosphorylation de protéines du cytosquelette et des micro filaments.
Ces modifications vont favoriser la migration des grains contenant l’insuline vers la membrane de la cellule ß. Il y a ensuite fusion et exocytose vers le courant circulatoire.
Les cellules ß peuvent recevoir des informations mettant en jeu des enzymes membranaires (phospholipase C = PLC) qui stimulées par PIP2, donnent :
- L’IP3 (second messager) qui provoque la libération du calcium contenu dans les organites du cytoplasme (forme alors le complexe calmoduline-Ca2+ qui favorise l’exocytose).
- Du diacylglycérol qui a un effet positif sur des protéines kinases C en leur permettant de phosphoryler le cytosquelette et les micro tubules afin d’augmenter l’exocytose.
Au niveau de la membrane plasmique, on trouve deux types de récepteurs couplés à l’adénylate cyclase :
- Les récepteurs α2 adrénergiques : par une protéine « G » inhibitrice, il y a diminution de l’adénylate cyclase, donc, diminution d’AMPc et finalement, réduction de l’exocytose.
- Les récepteurs ß adrénergiques (stimulés par la noradrénaline), sont couplés à une protéine « G » excitatrice.
Le neuropeptide pancréatique, au niveau central, stimule l’hypothalamus latéral (prise alimentaire) en entraîne donc l’inhibition de la sécrétion d’insuline.
Pour favoriser son action, l’insuline inhibe dans l’îlot, par effet paracrine, les cellules à glucagon. Quand la glycémie est revenue à la normale, le glucagon ré augmente et l’insuline diminue. Cette remontée de glucagon va favoriser au niveau hépatique, la reprise de la glycogénolyse afin de maintenir la glycémie.
L’insuline est une hormone favorisant l’entrée de glucose dans les tissus.
IV. Mécanisme favorisant l’entrée de glucose par l’insuline dans les tissus adipeux blancs.
Le glucose va être transformé en acide gras puis en triglycérides.
A. La pénétration du glucose.
La membrane porte des récepteurs à insuline qui, lorsqu’ils sont sous la forme du complexe hormone-récepteur, envoient un signal vers les transporteurs glucose en réserve. Ces derniers sont transloqués vers la membrane plasmique où ils se mettent en place pour favoriser l’entrée de glucose.
B. La dissociation du complexe hormone-récepteur.
Cette dissociation provoque l’internalisation des transporteurs. On dit alors que ces transporteurs glucose sont insuline-dépendants. L’absence d’insuline provoque la stagnation du glucose dans le milieu périphérique. Dans ce cas, le transporteur est le Glut4. Ce glut4 est aussi présent sur la membrane des fibres musculaires.
C. Pathologie.
Certaines pathologies se manifestent par une hyperglycémie à cause du Glut4 des tissus adipeux et musculaires qui entraîne l’augmentation du glucose périphérique. ? C’est le diabète de type 2.
D. Fonctionnement.
1. Première hypothèse.
La fixation de l’insuline sur les sous-unités a entraîne une auto-phosphorylation des sous-unités ß qui acquièrent alors la capacité de phosphoryler des substrats intracellulaires (tyrosine). L’interaction insuline/sous-unités a provoque le développement de l’activité tyrosine kinase. Des protéines phosphorylées donneront la réponse cellulaire.
2. Seconde hypothèse.
La fixation de l’insuline sur les sous-unités a entraîne une auto-phosphorylation des sous-unités ß qui permet l’apparition d’un second messager. C’est le métabolisme du glucose qui déclenche la libération d’insuline.
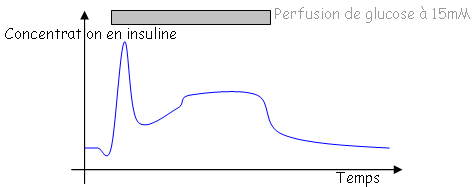
Cette réponse est typique d’un compartiment facilement mobilisable.
Le stimulus (glucose) excite les cellules ß qui vont sécréter l’insuline. Parallèlement, il existe une émiction (diminution), puis un rétablissement du fonctionnement.
L’entrée du glucose et la fermeture des canaux K+ permet l’entrée du calcium qui favorise l’exocytose en se concentrant de plus en plus dans le compartiment cellulaire. Cette croissance provoque la réouverture des canaux K+ et la fermeture des canaux Ca2+. On parle alors de sécrétion bimodale de l’insuline.
V. Les effets globaux de l’insuline.
A. Le métabolisme glucidique.
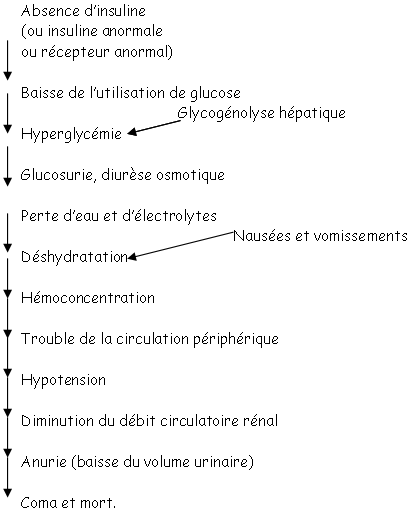
Si la concentration en glucose dépasse 1,8 g/L, le tube contourné proximal n’arrive pas à réabsorber tout le glucose : il reste dans la lumière puis passe dans l’urine.
B. Le métabolisme lipidique.
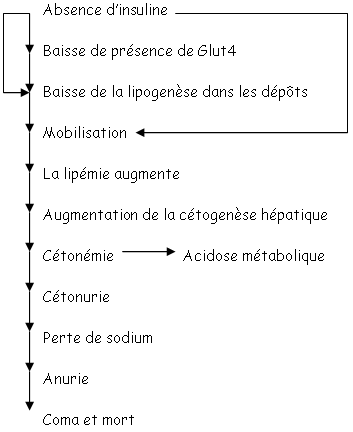
Les tissus adipeux ont deux fonctions :
- Ils réalisent la mise en réserve par la lipogenèse.
- Pendant le jeune, ils fournissent de l’énergie mais pour cela, ils ont besoin d’une enzyme (lipase) hormonosensible.
L’insuline régule la lipogenèse et la lipolyse par une mobilisation lipidique. Il y a alors augmentation des acides gras transportés, liés à l’albumine. Des lipoprotéines (les chylomicrons) transportent les acides gras vers la lymphe puis dans la circulation générale pour finir dans les tissus utilisateurs.
Pour le transfert des acides gras, il y a besoin de LipoProtéinesLipase (LPL) qui digère les triglycérides en acides gras qui peuvent alors pénétrer dans les tissus adipeux blancs pour participer à la lipogenèse. La LPL est stimulée par l’insuline. En absence d’insuline, il y a diminution de l’activité de la LPL et donc, une stagnation des chylomicrons : le plasma devient alors « laiteux ».
Dans ce cas, la grande arrivée de lipides dans le foie (dans les hépatocytes) développe une nouvelle voie métabolique : la cétogenèse. Les corps cétoniques obtenus passent dans la circulation, provoquent une cétonémie et une diminution de pH. On parle alors d’acidose métabolique (accumulations de sels cétoniques). De plus, il y aura perte de sodium et donc d’eau.
C. Le métabolisme protéique.
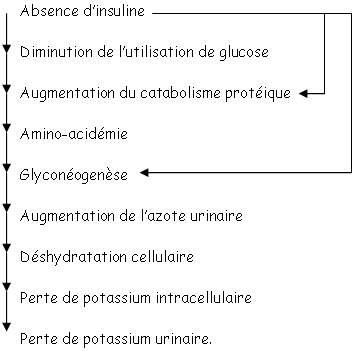
Le catabolisme des acides aminés, dans le foie, entraîne la synthèse d’urée qui provoque l’augmentation d’urée urinaire. Il y a alors déshydratation cellulaire, perte de potassium intracellulaire puis mort cellulaire.
VI. Les différents diabètes.
On trouve deux cas distincts de diabète.
A. Le diabète de type I.
Ce diabète ne peut être corrigé que par apport exogène d’insuline. Le sujet ne possède pas d’îlots de langerhans fonctionnels : on parle de diabète juvénile ou de type I.
B. Le diabète d’âge adulte.
Il y a apparition d’hyperphagie qui provoque une augmentation du poids. Les tissus adipeux deviennent de plus en plus résistants à l’insuline. Les îlots de langerhans vont accroître leur production d’insuline mais celle-ci sera toujours insuffisante pour permettre l’entrée de glucose. Pour soigner cette hyperglycémie, il y a différentes cibles et méthodes. On peut faciliter la synthèse d’insuline endogène grâce aux sulfamides hypoglycémiants ou favoriser l’activité de Glut4 par les biguanides.
Impossible de télécharger ce cours en HTTP (lien « mort »)
Erreur réparée… avec du temps, j’avoue. Toutes mes excuses !