BGU 09, Physiologie Animale :
Chapitre 4 : La Fonction Rénale.
Télécharger le document sur le serveur FTP ou sur le serveur web (HTTP).
I Introduction et présentation générale.
A Fonctions essentielles du rein.
1 Maintien de la composition du milieu interne.
Chez un sujet normal, le milieu intérieur dans lequel baignent les cellules, a une composition constante. Les électrolytes et l’eau apportées par l’alimentation sont absorbées par le tractus digestif et tendent à modifier ce milieu intérieur.
Les reins vont éliminer les surplus (en eau et électrolytes), de façon à maintenir un volume et une composition constante.
Les reins maintiennent donc un bilan nul pour l’eau et les substances dissoutes.
2 Excrétion des produits de dégradation du métabolisme cellulaire et des substances étrangères.
Les produits dérivés du métabolisme cellulaire qui n’ont pas de fonction connue doivent être éliminés (passer dans l’urine).
Par exemple : les acides, l’urée, l’acide urique (métabolisme des purines), la créatinine (provient de la créatine musculaire), la bilirubine et divers autres métabolites comme les dérivés de l’hémoglobine ainsi que des hormones à l’état de traces.
On trouve aussi des substances étrangères (xénobiotiques) qui y sont présentes et qui peuvent être toxiques ou thérapeutiques.
Par exemple, l’urée (O=C(-NH2)-NH2) a été la première molécule organique a être synthétisée, vers 1850, par Wholer (Suisse).
Beaucoup d’hormones ont été extraites à partir de quantités considérables d’urine.
3 Régulation de la pression artérielle systémique.
Le rein participe à cette régulation de deux manières :
- Par un contrôle du volume plasmatique (un des déterminants de la pression artérielle) et celui du volume extracellulaire, en ajustant les sorties des Na (sodium) aux entrées.
- Par la production d’une enzyme, la rénine, qui circule dans le sang et permet la mise en action d’un puissant agent vasoconstricteur qui intervient dans la régulation de la pression artérielle : l’angiotensine 2.
4 Fonction endocrine du rein.
On peut distinguer deux fonctions endocrines assurées par le rein.
Il va produire un métabolite de la vitamine D : le 1,25(OH)2D3. C’est une hormone qui contrôle l’absorption digestive du Ca (calcium) et qui intervient dans le métabolisme osseux.
Il produit également 90% de l’EPO (érythropoïétine).
B Compartiments liquidiens et échanges.
1 Compartiments liquidiens.
a L’eau totale.
L’eau représente en moyenne 60% du poids du corps. Cette valeur est plus importante chez le jeune, moins importante chez les personnes âgées. Chez la femme, le pourcentage est moindre, à cause de la quantité de tissu adipeux.
Pour une personne de 70kg, on va trouver 42 litres d’eau.
b L’eau du compartiment liquidien.
Ce volume est assimilé à 1/3 de l’eau totale (soit environ 14 litres). Cette eau est divisée en deux liquides :
- liquide interstitiel (80% soit 11,2 litres)
- plasma (20% soit, 2,8 litres).
Le cation prédominant est le sodium (Na) et les anions majoritaires sont Cl– et HCO3–.
c L’eau du compartiment intracellulaire.
Cette eau représente les 2/3 de l’eau totale (28 litres). Les cations prédominants sont le K+ et le Mg2+ ; pour les anions, on va trouver les phosphates organiques et les protéines.
Cette eau est très hétérogène selon les tissus.
On peut mesurer ces compartiments liquidiens par une méthode de dilution à partir d’indicateurs colorés. Le « bleu Evans » permet de mesurer le plasma.
On a aussi d’autres méthodes utilisant la radioactivité ou la chaleur.
2 Les masses échangeables.
Une part faible des électrolytes est bloquée par des liaisons chimiques dans les tissus. La grande partie est soumise à des échanges rapides (c’est la masse échangeable).
Le sodium échangeable : 90% dans le liquide extracellulaire ; 5% dans le liquide intracellulaire ; 5% dans les tissus conjonctifs.
Le potassium échangeable (K) : 98% dans le liquide intracellulaire ; 2% dans les liquides extracellulaires.
3 Mouvements d’eau et de substances dissoutes.
L’entrée se fait à travers l’endothélium capillaire, et ces échanges sont connus sous le nom de « loi de Starling », avec deux forces opposées mises en jeu :
- la pression hydrostatique (ou sanguine). Son sens est du plasma vers le milieu interstitiel
- la pression osmotique qui va en sens inverse.
A titre de bilan, au niveau des capillaires, 20 litres d’eau sortent du système vasculaire vers le système interstitiel. Seuls 18 litres font le trajet de retour. Les deux litres restant rejoignent indirectement le système des capillaires puis les vaisseaux lymphatiques.
II Physiologie du glomérule.
Cf. pages 52, 73, 74, 77.
Corpuscule (rénal) = Glomérule de Malpighi + Corpuscule.
Quelques valeurs< :
– Débit sanguin rénal (DSR) : 1 litre par minute (103mL), soit 20% du débit cardiaque. On a donc 1440 litres qui passent dans les reins chaque jour (/24heures).
– Débit plasmatique rénal (DPR) : 600 mL/min, soit 864L/24h
– Débit de filtration glomérulaire (DFG) : 125mL/min, soit 180L/24h. La fraction filtrée (FF) est le rapport entre DFG sur DPR, soit environ 20%.
– Débit urinaire (DU) moyen : 1mL/min, soit 1,44L/jour.
– Les éléments figurés ne sont pas concernés par la filtration.
A Le filtrat glomérulaire ou urine primitive.
1 Composition.
Le filtrat glomérulaire correspond à du plasma pratiquement sans protéine. Les traces autorisées de protéines dans l’urine sont de 10 à 20mg/L alors que le plasma contient environ 70g/L.
Dans cette urine primitive, on trouve des substances dissoutes non ionisées comme l’urée ou le glucose, qui traversent librement, mais aussi des substances ionisées (anions et cations) et d’autres substrats de petite taille.
A ce niveau, des éléments du sang sont liés aux protéines et ne peuvent passer la barrière glomérulaire (médicaments, hormones, lipides).
2 « Barrière » glomérulaire et macromolécules.
La barrière glomérulaire est assimilée à un filtre. On y trouve les pores de l’endothélium fenestré (Lamina fenestrata) dont le diamètre moyen est de 0,1 micron.
Par ailleurs, il y a la structure générale de la membrane glomérulaire, avec les podocytes et les pédicelles (Capsule de Bowman) qui forment des fentes de filtration de 7nm.
Pour passer ce filtre, différentes caractéristiques seront exigées :
- taille de la molécule (Poids moléculaire), par exemple, les albumines (70 000Da) sont les plus grosses molécules à pouvoir passer ;
- charge électrique : les molécules de poids moléculaire faible, mais chargées négativement passent mal la membrane glomérulaire car celle-ci a un charge négative.
Ces caractéristiques ont été mises en évidence grâce à une molécule de taille et de charge variable : le Dextran.
On doit citer le problème de protéines et de leur présence problématique dans les urines : protéinurie ou albuminurie. Le taux normal de protéines est inférieur à 0,15g/24heures. Au-delà, la présence de protéines dans l’urine est pathologique.
Quelques explications à ce phénomène :
- La diminution du DSR : il y a contact plus prolongé entre l’albumine plasmatique et la barrière glomérulaire. Ce phénomène peut être due à des exercices musculaires violents, des états fébriles, des insuffisances cardiaques.
- L’augmentation pathologique de la perméabilité de la membrane glomérulaire aux albumines. Cet accroissement peut être observé à cause d’hypertension prolongée et de glomérulopathies (seul cas où l’urine contient des lipides).
3 Déterminants ou facteurs de la filtration glomérulaire (FG).
La filtration glomérulaire est un phénomène passif. On appelle Pression Nette de Filtration (ou PNF) ==> PNF = PS – (PC + PO) (PC = Pression Capsulaire).
6,65 – (1,33 + 4,00) = 1,32 KPa
PNF = ΔP – σΔπ = 50 – 10 – 30 = 10mmHg
ΔP est la différence de pression hydrostatique entre les capillaires glomérulaires et la capsule de Bowman.
S est le coefficient d’extraction qui est déterminé par la perméabilité aux protéines dans le filtre glomérulaire : S est voisin de 1.
Δp est la différence de pression coloïdo-osmotique. Cette différence est associée à l’équilibre de Donnan et tend à retenir l’eau et les électrolytes (ou osmolytes) dans la capsule de Bowman.
L’équilibre de Donnan équivaut à une inégale répartition des solutés ioniques entre deux compartiments liquidiens de l’organisme, associée à l’inégale concentration en gros anions non perméants (protéines).
1mm de Hg équivaut à 0,133KPa
La formule globale montre qu’il s’agit d’un système dynamique qui varie selon la longueur des capillaires des glomérules.
Le ΔP varie peu en diminuant ; Δπ augmente progressivement car, comme la barrière glomérulmaire est perméable aux protéines, elles se concentrent dans les capillaires au fur et à mesure que se développe la filtration glomérulaire.
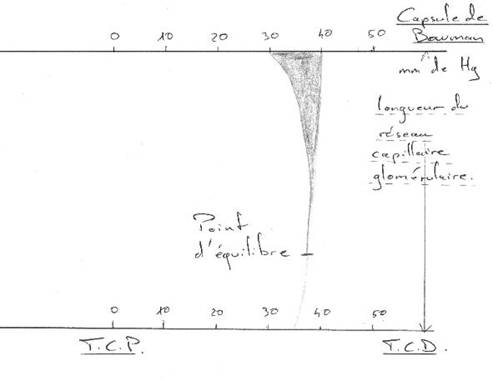
En gris, on a la zone de PNF (Pression Nette de Filtration). ΔP diminue peu (d = 40 à 35). Δπ augmente à partir de 30 mmHg et, arrivé au 2/3 de la longueur du capillaire artériel glomérulaire, elle rejoint ΔP (point d’équilibre). La filtration glomérulaire n’exploite pas la totalité de la surface capillaire du glomérule.
4 Facteurs influençant la DFG (Débit de filtration glomérulaire).
a Débit Plasmatique Rénal (DPR).
Ce débit est un facteur important pour le DFG, par exemple, si le DPR croit, on va avoir un DFG qui croit à son tour.
b Résistances artériolaires.
On envisage une vasoconstriction de l’artériole afférente. Il y a :
- résistance à l’écoulement,
- diminution du DPR,
- diminution de la pression hydrostatique capillaire.
Les deux derniers facteurs dont une diminution du débit de la filtration glomérulaire (DFG).
c Pression artérielle systémique.
Cette pression varie entre 80 et 160 mmHg. Malgré cette variation, le DSR ne varie pas et le DFG reste stable. Mais, si la pression artérielle devient inférieure à 80 mmHg, il va y avoir une diminution du DSR et du DFG.
d Autres déterminants.
Une obstruction aigue, ou incomplète des voies urinaires va provoquer une augmentation de la pression hydrostatique dans la capsule de Bowman. La conséquence de cette augmentation de pression est une diminution du DFG.
III Régulation du Débit Sanguin Rénal (DSR) et du Débit de Filtration Glomérulaire (DFG).
A Facteurs influençant le DSR et le DFG.
1 Contrôle nerveux.
Les vaisseaux du rein reçoivent une riche innervation par le système orthosympathique qui permet l’action de vasoconstriction avec diminution du DSR. Toutefois, le DFG va diminuer peu car l’action du système orthosympathique porte surtout sur l’artériole afférente, ce qui maintient une différence de pression.
2 Contrôle hormonal.
a Le système Rénine-Angiotensine.
La rénine est une enzyme protéolytique sécrétée par les cellules granulaires de l’appareil juxta-glomérulaire (puis, passage dans le sang).
On trouve la séquence classique :
Angiotensinogène : Angiotensine (décapeptide) grâce à l’action de la rénine : Angiotensine 2 grâce à l’action d’une convertase, présente dans les cellules épithéliales. Le dernier produit formé a une action de vasoconstriction.
Remarque : il y a passage de la forme Angiotensine 2 à la forme Angiotensine 3.
L’angiotensinogène est un précurseur inactif de type protéine globuline, hépatique.
La vasoconstriction observée est principalement localisée dans l’artériole afférente et va provoquer une chute du DSR et à un degré moindre, une chute du DFG.
La rénine est sécrétée quand le rein est mal irrigué : quand la pression artérielle chute et que cette chute est perçue par les cellules granulaires, ce qui va stimuler des fibres du système orthosympathique, puis stimuler des cellules de la Macula Densa qui sont des réceptrices de la composition en Na+ dans le tube contourné distal.
b L’ensemble des prostaglandines.
Les prostaglandines sont synthétisées dans le rein, au niveau des tubes collecteurs. A leur origine, on trouve l’acide arachidonique modifié par l’action de la cyclo-oxygénase.
Ici, on trouve PGL1.
L’action de cette molécule est une vasodilatation.
c L’ensemble des kininogènes.
Kininogène –> BradyKrinine (grâce à la Kallicréine)
Précurseur inactif –> peptide –> synthétisée par les cellules du TCD
La Bradykinine a une action vasodilatatrice et va donc faire croître et le DSR et le DFG.
d Malpighi ou Facteur Atrial Natriurétique.
Malpighi est un peptide sécrété par les myocytes cardiaques de l’oreillette, lorsque celle-ci est trop dilatée. Son action est vasodilatatrice
C’est un facteur inverse à celui de l’hémorragie.
On peut voir que ces trois familles de produits ont une action antagoniste à l’angiotensine.
B Autorégulation du DSR et du DFG.
Les travaux ont été réalisés sur des reins isolés et perfusés (sans innervation), mais avec l’action d’hormones. Seule la pression de perfusion sera changée.
La variation va être comprise entre 80 et 160 mmHg, alors que les variations de DSR et de DFG vont être très faibles.
Deux mécanismes sont proposés pour expliquer ce phénomène.
1 Mécanisme myogénique.
Si on augmente le débit de perfusion, on provoque un étirement de la paroi vasculaire de l’artériole afférente. Il y a alors immédiatement une vasoconstriction et une diminution du diamètre de celle-ci. Le DSR reste ainsi à peu près constant.
2 Rétrocontrôle tubulo-glomérulaire.
Ce rétrocontrôle est un mécanisme au niveau de chaque néphron. Ici, le DSR et le DFG de chaque néphron seront sous le contrôle des variations de débit et de la composition du fluide tubulaire, au niveau de la macula densa, après l’anse de Henlé.
Ces mécanismes sont toujours mal connus.
3 Adaptations aux variations de la volémie3
a Régime sans sodium.
Si ce régime est modéré et chronique, on assiste à une hypovolémie de l’ordre de 5%, et donc, à une chute du retour veineux, du retour cardiaque et de la pression artérielle.
On a diverses réactions possibles de l’organisme :
- stimulation des barorécepteurs artériels de la crosse aortique et des carotides
- stimulation du système orthosympathique
- stimulation de l’artériole afférente qui va produire la rénine, et donc, une vasoconstriction.Le rôle du rein pour la régulation de la pression artérielle est modéré ; l’essentiel de son action est de maintenir constante la filtration glomérulaire.Dans le cas d’une hémorragie aigue, on observe successivement : une hypovolémie, une chute d’environ 30% de la pression artérielle, puis une baisse d’environ 30% du DSR mais seulement 20% de baisse du DFG.
IV Physiologie du tubule.
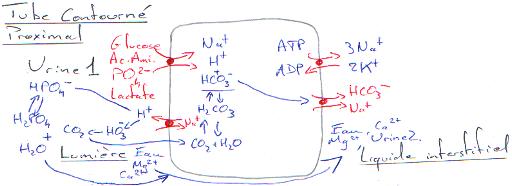
Dans les cellules, on va distinguer deux niveaux :
- Membrane apicale : placée du coté de la lumière du tube, avec beaucoup de jonctions.
- Membrane baso-latérale : coté liquide interstitiel.
On distingue deux types de passage :
- Trans-cellulaire : où il faut traverser la cellule.
Ce transport est lié à un gradient actif de sodium. On le trouve dans le tube proximal, la branche ascendante, large de Henlé, et le tube contourné distal.
- Paracellullaire : entre deux cellules voisines.
Dans ce cas, on a un flux d’eau qui emprunte les passages entre les cellules. On trouve ce passage au niveau du tube contourné proximal, du tube contourné distal et du tube collecteur.
Le tubule proximal est le siège d’une réabsorption intense. Le gradient de sodium dans les tubules proximaux est déterminant dans les mécanismes de réabsorption.
La pompe Na/K – ATPase de la membrane exporte activement le sodium dans le liquide interstitiel. Le gradient intracellulaire provoque l’entrée passive de sodium.
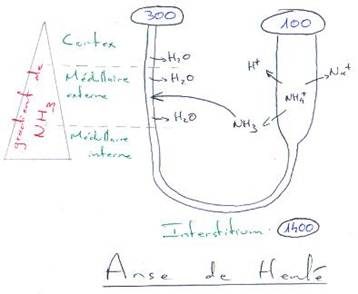
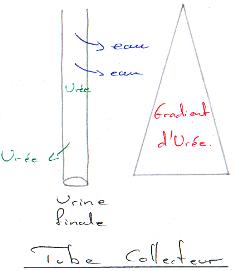
V Gradient osmolaire de concentration à contre-courant cortico-médullaire.
Ce gradient est possible dans la anse de Henlé et uniquement dans les néphrons profonds et juxta-glomérulaires ; ce qui correspond à 20% des néphrons chez l’Homme.
Le rein est irrigué par 1.25 litre par minute. Les éléments figurés de sont pas concernés. On a 700mL de plasma et 20% du plasma est filtré par les glomérules : soit, 125mL au total.
A Au niveau des tubules.
1 Le tube contourné proximal.
Ici, la réabsorption est intense : 100% du glucose et du potassium (K). Pour le sodium (Na), l’eau et le bicarbonate, la réabsorption est d’environ 85%. Le phénomène de réabsorption d’eau est OBLIGATOIRE.
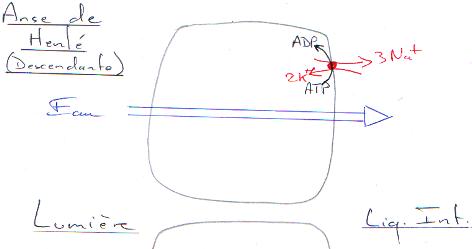
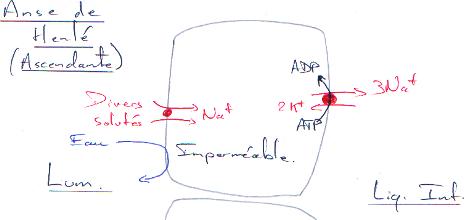
2 La anse de Henlé.
On trouve ici un système à contre-courant (branches ascendante/descendante) mais surtout un sens de mouvement du filtrat et un sens de mouvement du sang des vasa recta.
Il y a réabsorption active du sodium (Na) qui va permettre la réabsorption de l’eau.
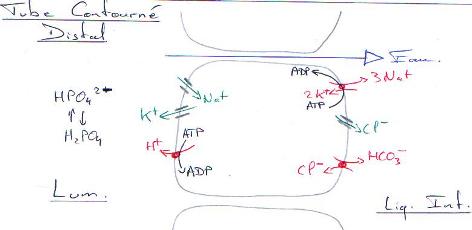
3 Le tube contourné distal.
A ce niveau, du sodium est réabsorbé. Des ions K+ et des ions NH4+ vont être sécrétés.
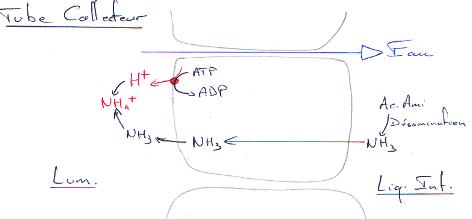
4 Le tube collecteur.
Ici, la réabsorption d’eau est possible grâce à l’action de l’ADH qui permet de concentrer l’urine.
B Fonctionnement des branches de la anse de Henlé.
La branche ascendante, dans sa partie fine est imperméable à l’eau et n’est le siège d’aucun mécanisme actif : les solutés diffusent selon le gradient (du filtrat vers l’interstitium pour le Na+ et l’inverse pour l’urée).
L’absorption de Na+ constitue l’effet élémentaire du gradient d’osmolarité entre le tubule ascendant et l’interstitium.
La branche descendante est très largement perméable à l’eau. Cette perméabilité permet un rééquilibrage osmotique entre le filtrat descendant et l’interstitium.
Ainsi, à la fin de la anse, l’osmolarité est la même dans l’espace intercellulaire, soit environ 1400mOsl/L (valeur maximale pour l’Homme).
Cette concentration progressive du filtrat entraîne son alcalinisation le long de la branche descendante : l’ion HCO3– diffuse mal alors que le CO2 est très diffusible.
Le filtrat tubulaire a son pH qui passe de 6,8 à 7,4. On assiste donc à la transformation d’une partie du NH4+ en NH3 qui est facilement diffusible et qui s’accumule dans la zone médullaire interne. Cette concentration en NH3 est estimée comme étant 12 à 20 fois supérieure à celle de la zone corticale
On est en présence d’un gradient d’ammoniac.
C Les mécanismes multiplicateurs à contre-courant.
1 Le moteur de la création du gradient est donc :
- La réabsorption du Na+le long de la branche ascendante de façon active dans sa partie large et passive dans la partie fine.
- La diffusion de l’urée de long du tube collecteur.La dynamique de circulation de filtrat et la disposition à contre-courant des deux branches aboutissent à une multiplication progressive de l’écart des concentrations en soluté entre le cortex et la médullaire. Il en résulte :l’installation d’un gradient de concentration proprement dit (300 à 1400) ==> Mécanisme amplificateur ; le filtrat issu du tube contourné proximal est en équilibre osmotique avec le plasma (300) alors que le filtrat du tube contourné distal est hypotonique (100).
2 Entretien du gradient osmotique cortico-médullaire.
Le maintien de ce gradient est assuré par l’action de deux mécanismes :
- La disposition antiparallèle des vasa recta avec les deux branches de l’anse de Henlé ;
- Le débit sanguin dans les vasa recta est faible à cause de la forte résistance vasculaire de l’artériole efférente glomérulaire. Cette diminution du débit sanguin améliore les échanges entre le plasma et l’interstitium et porte ainsi le gradient cortico-médullaire à sa valeur maximale.
D Le glucose et le rein ou Glycémie et glycosurie.
La concentration en glucose du plasma est de l’ordre de 0,8g/L, soit 4,44 à 5,55 mMole/L, dans des conditions physiologiques normales, avec une élimination urinaire nulle pour le glucose.
Si l’on réalise une injection de glucose en intraveineuse, du glucose va apparaître dans les urines : c’est la glycosurie.
Le seuil où apparaît la glycosurie est atteint pour 14 mMole/L (ou 2,5 g/L). Cela signifie que la réabsorption du glucose dans le tube contourné proximal est contrôlée et qu’il y a réabsorption jusqu’à ce seuil de 2,5 g/L. Au-delà de cette valeur, le glucose est excrété dans l’urine.
1 Notion de taux maximal de glucose (= TmG).
Le débit de réabsorption de glucose augmente jusqu’à une valeur de 22mMole/L, soit 4 g/L. Ensuite, il y a stabilisation à cette valeur maximale. Cette valeur est appelée TmG : elle est très constante et est d’environ 2mMole/min.
Cela s’explique par une saturation des protéines du cotransport Na+/Glucose au niveau de la membrane apicale des cellules du tube contourné proximal.
2 Epaulement.
La glycosurie apparaît souvent quand le débit de réabsorption n’atteint pas sa valeur maximale.
Cela peut s’expliquer soit par des propriétés intrinsèques aux protéines de cotransport Na+/glucose ; soit par une diversité du TmG entre les néphrons. De cette façon, les courbes de réabsorption et de sécrétion sont arrondies (on parle aussi d’épaulement).
veuillez nous explquer pourquoi le potentiel hydrique des certaines paties du nephron est positive alors que sa valeur la plus elevee 0 et le reste est negative