Sexualité – Reproduction :
Chapitre 4 : Les déterminismes du sexe.
Télécharger le document sur le serveur FTP ou sur le serveur web (HTTP).
I Historique.
Le déterminisme du sexe préoccupe les embryologistes depuis l’antiquité. Aristote est le premier embryologiste connu. Au quatrième siècle avant JC, il pensait que le sexe était déterminé par la température du partenaire mâle, durant le rapport sexuel. L’hypothèse émise est que le gamète femelle était un gamète mâle mutilé dont le développement avait été stoppé car la froideur de la matrice avait dominé sur la chaleur de la semence mâle. Il pensait aussi que les organes sexuels femelles n’avaient pas maturé suffisamment pour donner une semence active.
Claude Galien, un anatomiste, disait que comme l’espèce humaine était la plus parfaite des espèces et que l’homme est plus parfait que la femelle grâce à son excès de chaleur. Les organes de reproduction se forment dans le fœtus mais la formation des organes femelles ne se poursuit pas (neuvième siècle).
Au seizième siècle, un anatomiste, André Vésale, considérait que Galien avait raison à propos des organes génitaux. Il a émis l’idée que les femelles avaient le même nombre de côtes que le mâle.
Les anatomistes ont abandonné l’anatomie femelle proposée par Galien.
Au 17ème siècle, De Graaf considérait que la femelle produisait des œufs ; cependant, on ignorait le rôle des œufs et des spermatozoïdes dans la constitution des descendants.
Au 18ème siècle, Spallanzani émit l’idée des deux gamètes pour la constitution d’un nouvel individu. On pensait aussi que l’environnement où se développait l’œuf pouvait avoir une influence sur le déterminisime du sexe : température et nutrition.
Au 19ème, Geddes et Thomson affirment que les facteurs qui favorisent l’accumulation d’énergie et des éléments nutritifs prédisposent une descendance femelle alors que les facteurs favorisant l’utilisation de ces éléments prédisposent une descendance mâle.
McClung, en 1902 remet en cause la prédominance environnementale. C’est la théorie de la détermination chromosomique du sexe qui apparaît.
Carl Correns émit l’hypothèse que pour la majorité des espèces, on devrait arriver à une proportion de 1/1 pour les femelles/mâles, et ceci en supposant que les mâles sont hétérozygotes et que les femelles sont homozygotes pour les facteurs de détermination du sexe.
Les travaux de Stevens, 1905, et de Wilson ont établi une corrélation entre le sexe femelle et les chromosomes sexuels XX ainsi que la corrélation entre le sexe mâle et les chromosomes XY ou X0. Ils ont supposé qu’un composé nucléaire spécifique était responsable du phénotype sexuel. La détermination est due) des évènements héréditaires et non environnementaux.
Les facteurs génétiques et environnementaux contribuent au déterminisime du sexe selon les espèces considérées (un des facteurs est prédominant).
II Déterminisme chromosomique du sexe.
Le sexe chromosomique influence le sexe gonadique qui lui-même influence le développement des organes génitaux : ce sera le sexe phénotypique. Chez de nombreuses espèces, il y aura intervention de centres nerveux qui joueront un rôle.
Dans l’espèce humaine, on parle en plus du sexe phénotypique, de sexe psychologique et de sexe social.
L’individu peut provenir d’un bourgeonnement d’un unique individu : reproduction asexuée, soit du développement d’un œuf : reproduction sexuée. Les deux processus ne sont pas exclusifs l’un de l’autre et peuvent se succéder (exemple : l’hydre).
Dans la reproduction sexuée, il y a présence de gamètes et de la fécondation ou de la parthénogenèse.
Les espèces gonochoriques ont des individus qui sont soit mâle soit femelle alors que les espèces hermaphrodites ont des individus à la fois mâle et femelle.
Chez les insectes, Wilson a trouvé les chromosomes X et Y chez les mâles. Les hétérochromosomes ne sont pas toujours discernables mais dans les espèces gonochoriques, le sexe ratio est de une femelle pour un mâle : une paire de chromosomes doit porter des allèles ou des gènes différents. Une paire de chromosomes porte un segment différentiel : différent entre les deux sexes.
Les hétérochromosomes sont différents des autosomes de par leur comportement lors des divisions cellulaires :
- Les hétérochromosomes migrent aux pôles avant les autosomes (phénomène de précession) ;
- Les autosomes migrent après les hétérochromosomes : phénomène de succession.
La méiose répartie les hétérochromosomes dans les gamètes selon deux possibilités :
- Si l’on a 2 X, l’individu élabore un seul type de gamète : X ; on parle de sexe homogamétique ;
- – Si 50% des gamètes héritent d’un X et 50% héritent d’un Y, l’individu élabore alors deux types de gamètes ; on parle de sexe hétérogamétique.
Selon les espèces, c’est soit la femelle, soit le mâle qui est hétérogamétique :
- Hétérogamétie mâle : 2nA + XY ou 2nA + X0
- Hétérogamétie femelle : 2nA + ZW ou 2nA + Z0
On détermine cela en faisant un caryotype et quand les hétérochromosomes sont discernables des autosomes. Chez Pleurodeles, la paire de chromosomes 4 porte un segment différentiel et la femelle est 2nA + ZW.
Humphrey : quand le caryotype ne permet pas de déterminer le sexe, on peut faire une expérience comme par exemple sur l’axolotl (batracien, urodèle). Au stade embryonnaire, on greffe une ébauche présomptive d’une gonade mâle sur un embryon femelle à la place de son futur ovaire gauche. Au stade larvaire, on enlève cette gonade.
Les résultats :
On a une femelle masculinisée et l’autre gonade élabore des spermatozoïdes : c’est un néo-mâle obtenu à partir d’une femelle génétique. A l’âge adulte, on croise le néo-mâle avec une femelle normale : on obtient alors beaucoup plus de femelles que de mâles : le sexe ratio est donc anormal. Les femelles WW sont normales et fertiles.
[table id =1 /]
On a ¾ de femelles et ¼ de mâles.
Si l’on croise des individus entre eux : si l’on croise une femelle WW avec des mâles normaux, on n’aura que des femelles.
[table id =2 /] [table id =3 /]
Si la femelle engendre :
- Les deux sexe : c’est une femelle amphogène ;
- Un des sexes : c’est une femelle thélygène (monogénie) ;
- Uniquement des mâles : c’est une femelle arrhénogène (monogénie).
Les femelles thélygènes se retrouvent aussi chez les poissons où elles sont WW.
Il existe des individus particuliers présentant des parties morphologiquement mâles et des parties morphologiquement femelles : ce sont des individus gynandromorphes. On trouve des exemples de ces individus chez les drosophiles.
Chez les drosophiles, les mâles hétérogamétiques sont 6A + XY et les femelles, homogamétiques, sont 6A + XX. La présence de gynandromorphe est possible car lors de la première caryocinèse (première division de l’œuf) d’un zygote XX, il va y avoir perte de l’un des chromosomes X : un des noyaux fils a alors la constitution X0.
Chez ces drosophiles, les territoires XX donnent des territoires morphologiquement femelles alors que les territoires X0 donnent des territoires morphologiquement mâles.
A Relation entre les hétérochromosomes et le sexe de l’individu.E
Chez les papillons, certains œufs sont binucléés car un premier globule polaire n’est pas émis. Chez les drosophiles, il peut ne pas y avoir émission du globule polaire et l’espèce est monospermique. Les papillons Bombyx sont polyspermiques et de type abraxas pour la détermination du sexe (ZW).
Lors que la fécondation, les deux noyaux femelles peuvent fusionner avec deux pronucléi mâles différents.
Femelle ZW x Mâle ZZ –> ZZ et ZW.
Chez l’abeille, il arrive que certains oeufs soient binucléés:
- Femelle : 32A + XX (2N)
- Mâle : 16A + X (N).
Un noyau spermatique fusionne avec un des noyaux femelles : formation d’un noyau XX : femelle 32A + XX.
L’autre noyau ne fusionne pas avec les spermatozoïdes : formation d’un noyau X : mâle 16A + X.
Le sexe est déterminé au moment de la fécondation. Les individus issus d’un seul œuf sont du même sexe (par exemple, le tatou) : on parle de polyembryonie. C’est le cas des jumeaux dans l’espèce humaine.
B Rôle du chromosome Y chez la drosophile et des autosomes.
Les travaux de Morgan sur l’hérédité liée au sexe montrent que le chromosome Y porte peu de gènes. Les individus XXY sont des femelles alors que les individus X0 ont un phénotype mâle. Y ne porte donc pas de gènes masculinisant. Le chromosome Y intervient très tard dans le développement lors de la spermatogenèse (sur la mobilité des spermatozoïdes) mais Y est utile au mâle pour sa fertilité. Chez les drosophiles polyploïdes, les manipulations montrent que les gènes de la sexualité sont en partie portés des autosomes.
Rapport du nombre de chromosomes X en fonction du nombre de lots d’autosomes (= X/nA)
- Rapport compris entre 0,5 et 1 : individu intersexué. Exemple : 2nA + XY = 6A + XY –> X/nA = ½ = 0,5
- Supérieur ou égal à 1 : femelle. Exemple : femelle 2nA + WW –>2/2 = 1.
Détermination : résultat d’une balance génétique. Les gènes masculinisant sont portés par les autosomes et les féminisant sont portés par le X.
III Rappels de la structure des chromosomes sexuels X et Y.
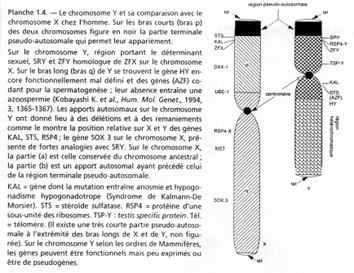
La région en noire correspond à la région pseudo autosomale. Les gènes retrouvés ici ont une origine ancestrale autosomale : sauf mutations, entre le chromosome X et le Y, ces gènes sont équivalents.
C’est ici que se produit un crossing-over (obligatoire). Ces chromosomes sont isolés des autosomes dans une vésicule sexuelle pendant la gamétogenèse.
Sur le X et le Y, certains gènes se retrouvent mais à des emplacements différents : STS, KAL. Au départ, ces gènes étaient dans une région analogue, mais des remaniements sont intervenus : deux cassures sur le bras court de Y –> STS et KAL se trouvant entre les deux cassures vont être insérés dans le bras long de Y (grâce à encore une autre cassure).
Le gène ZFX (sur X) a un homologue sur Y : ZFY. Le gène XIST, sur le bras long de X est un gène intéressant, intervenant dans l’hétérochromatinisation du chromosome X chez les individus possédant deux X. Le gène SOX3, aussi sur le bras long de X, présente une forte homologie avec SRY (SRY est le gène maître de la mise en place du testicule). SOX3 aurait dévié de SRY et il ne s’exprime pas dans le testicule.
Chez les poissons Oryzia latipes, on a transformé des embryons XY (mâles) en femelles fertiles par un traitement (au stade embryonnaire) à la 17ß-oestradiol (hormone). Dans la descendance obtenue, on retrouvera des individus YY : chez certains vertébrés, l’absence du X n’est pas létale.
Par la suite, il y a eu évolution (chez les mammifères entre autre) où X et Y se sont spécialisés et où X est devenu indispensable.
Par exemple, chez la souris, 2N = 40 ; chez la femelle, on a 38A (autosomes) + 2X ; chez le mâle, on a 38A + XY.
Il faut noter que chez cette souris, la configuration 38A + X0 donne des femelles normales. Sans Y, on a une différenciation femelle.
Syndrome de Turner : 38A + XXY : ce sont des individus mâles stériles. Le chromosome Y porte des gènes de structure et/ou régulateurs, gouvernant la différenciation mâle. Ces gènes sont sur le bras court du Y. En l’absence du bras court du Y, on notera l’apparition d’un phénotype femelle, comme chez les X0.
Y semble indispensable au bon fonctionnement de la spermatogenèse.
Chez les marsupiaux (genres Perameles / Isoodon), les cellules somatiques mâles sont X0 ; seules les spermatogonies sont XY. Il y a élimination du Y des cellules somatiques.
Dans les souris mosaïques, on retrouve 39A, X / 41A, XYY (obtenue après une première division de segmentation normale de zygote normal). Les deux chromatides sœur du Y vont dans un seul pôle du fuseau. Les spermatogonies seront uniquement XYY (les spermatogonies X0 étant éliminées).
Chez l’Homme, la perte de la région distale du bras long du Y est compatible avec la différenciation de la gonade mais sans spermatogenèse.
Sans le gène AZF, ou le gène HY, il n’y a pas non plus de spermatogenèse. On parle d’anosmie.
Les cellules initiales germinales XX ne peuvent accomplir les stades précoces de la spermatogenèse et les cellules initiales XY de femelle dégénèrent avant la puberté (il n’y a pas de phase de grand accroissement : blocage au stade dychtié).
Toutes les données obtenues ne constituent que des preuves indirectes du chromosome Y (de son rôle) et il faut bien penser qu’il existe une interaction entre les cellules germinales et somatiques pendant la gamétogenèse.
Le rôle fondamental de SRY a été mis en évidence en 1990.
Le génotype X0 (syndrome de Turner) donne des individus de phénotype femelle, stérile, avec de nombreuses anomalies dont des anomalies cardio-vasculaires.
Le génotype XXY (syndrome de Klinefelter) donne des individus de phénotype mâle, stérile. Les tubes séminifères sont présents, mais sans cellules germinales. On trouve des traits féminins comme la gynécomastie. La présence des deux chromosomes X n’est pas anodine. Un de ces X va être inactivé comme chez les femelles « normales » et donner un corpuscule de Barr.
Malgré l’inactivation de l’un des deux X, des gènes peuvent continuer à fonctionner.
IV Compensation du dosage génique et empreinte génomique parentale (EGP).
A Compensation du dosage génique.
Chez les mammifères, les femelles ont deux X et les mâles, un seul. Il va y avoir mise au silence de l’un des deux X chez la femelle, par inactivation. Ce phénomène rétablit à peu près la quantité de produits synthétisés à partir du seul X actif des mâles.
B L’empreinte génomique parentale.
Cette empreinte se concrétise par l’expression mono-allélique de certains gènes. Pour certains de ces gènes, seul l’allèle paternel sera exprimé ; et inversement. Ces gènes sont soumis à ce phénomène d’EGP ; on dit aussi qu’ils sont « imprimés ». Ces gènes peuvent aussi bien être portés par les autosomes que par les chromosomes sexuels (X).
Ces deux phénomènes présentent une similitude pour les mécanismes mis en œuvre pour la répression des gènes : méthylation, ARN non-codant.
Remarques : Tous les gènes portés par le X inactivé ne sont pas inactifs ! Certains s’expriment, comme ceux de la région pseudo-autosomiale, mais aussi certains gènes portés par le bras court du X (KAL, STS, ZFX).
Xi (X inactivé) est sous forme hétérochromatique (Corpuscule de Barr). On constate qu’il est constitué d’hétérochromatine facultative et de chromatine constitutive.
C L’Inactivation du X.
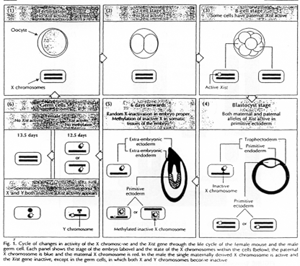
L’inactivation du X, comme l’EGP est un phénomène épigénétique : modification de l’expression des gènes, sans modifier la séquence de nucléotides.
L’inactivation du X est transmise clonalement.
Dans les cellules somatiques, l’inactivation est stable et irréversible. L’inactivation du X et l’EGP sont réversibles dans les cellules de la lignée germinale (pendant la gamétogenèse).
Chez les marsupiaux, l’inactivation du X fait intervenir l’EGP : c’est le X d’origine paternelle qui va préférentiellement être inactivé.
Normalement, l’EGP ne sera pas effacée dans le trophectoderme. Dans le bouton embryonnaire, l’inactivation du X est aléatoire. Dans le trophoblaste, c’est le X paternel qui sera préférentiellement inactivé.
1 Mécanismes d’inactivation du chromosome X.
Deux gènes principaux sont impliqués dans l’inactivation : XIST (chez l’Homme et Xist chez la souris) et TSIX (chez l’Homme et Tsix chez la souris). TSIX : Transcrit spécifique du X inactivé.
Ces deux gènes sont proches l’un de l’autre, dans la région « XIC » (Centre d’inactivation du X) du chromosome.
On pense que dans XIC, se localise Xce (éléments de contrôle de X) mais aussi d’autres gènes à découvrir.
Cette inactivation semble comporter trois étapes : l’initiation / la propagation / la stabilisation.
La délétion de la région XIC de l’un des deux chromosomes X protège le délété de l’inactivation.
Le gène XIST est constitué de plusieurs exons. Le transcrit primaire subit un épissage et une polyadénylation (en 3’). Toutefois, l’ARN de XIST ne sera pas traduit en protéine.
C’est un ARN non-codant (de grande taille). Chez la souris, il représente 15.000 nucléotides et 17.000 nucléotides chez l’Homme.
Le gène TSIX est traduit en sens inverse de XIST. C’est aussi un ARN non-codant, antisens.
Le gène XIST n’est transcrit qu’à partir du X inactif (souvent du chromosome d’origine femelle). Son expression précède l’inactivation du X, qu’elle soit liée à l’EGP ou bien qu’elle soit aléatoire.
De nombreux travaux ont montré une corrélation entre le degré de méthylation des îlots CPG (au niveau des régions régulatrices) et l’activité transcriptionnelle des gènes.
Si le promoteur et/ou l’enhancer (amplificateur) sont méthylés, il y aura « silence » du gène.
Quand le promoteur XIST est méthylé, le gène XIST est réprimé.
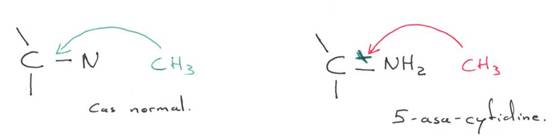
Par ailleurs, des équipes, en travaillant sur des cellules mâles, en milieu de culture, mettant de la 5-asa-cytidine (inhibiteur de la méthylation sur le carbone 5 de la cytosine) observent que le gène XIST s’expriment initialement mais que dans les cellules qui se divisent, ce gène va cesser de s’exprimer.
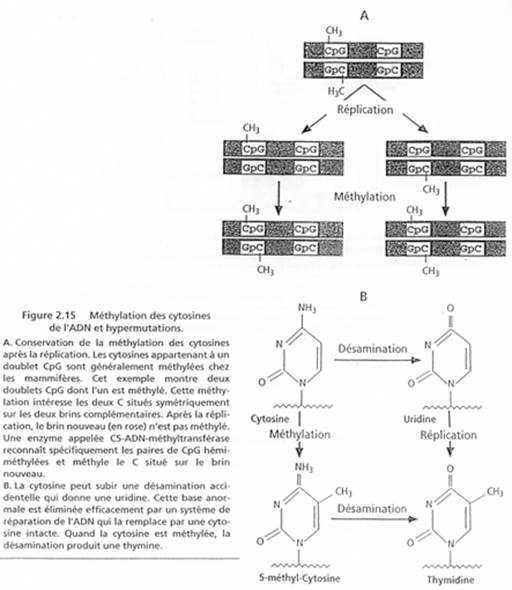
Les deux brins d’ADN sont méthylés. Si XIST s’exprime, le X sera inactivé.
2 La phase de propagation.
Au début, les ARN sont instables. Ils doivent être stabilisés. L’ARN de XIST agit comme s’il habillait le chromosome.
Des protéines vont intervenir pour stabiliser cette ARN de XIST. Ces protéines de stabilisation entrent en contact avec les protéines de la chromatine.
3 La phase de stabilisation.
La stabilisation demande des modifications de la chromatine :
- Méthylation des promoteurs.
- Dé-acétylation des histones.
- Modification de la chromatine (dont l’intervention de macro H2A).
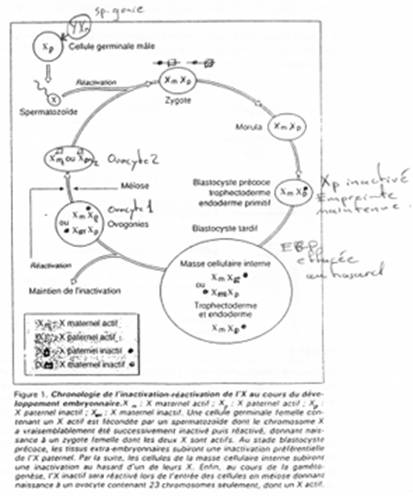
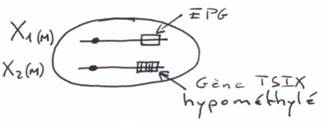
Dans les embryons normaux, au stade blastocyste, les cellules du trophoblaste des embryons mâles et celles des embryons femelles, expriment le gène TSIX et ce, uniquement à partir du chromosome maternel.
Pour les embryons mâles, le X maternel est actif (Xa). Pour les embryons femelles, le X maternel est également actif (Xa) mais le X d’origine paternelle est inactif (Xip).
On a une expression exclusive de XIST ou de TSIX. Sur le X maternel, TSIX ne s’exprime pas.
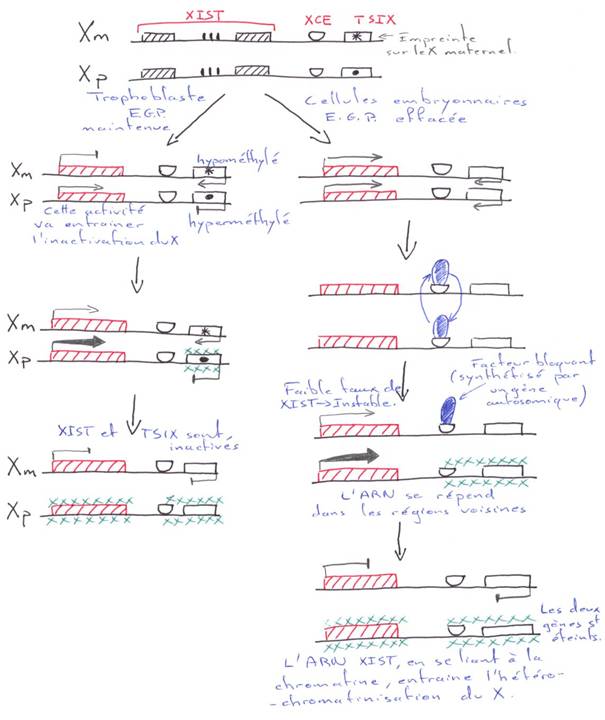
4 Dans les cellules embryonnaires.
L’ARN de XIST est instable (< XIST trophoblastique).
Sur le X qui ne va pas être inactivé, un « facteur » vient arrêter le fonctionnement de XIST.
Lorsque l’on a un surnombre de X, on peut se demander comment se fait « le comptage » des X. En fait, on suppose que le fonctionnement de ce comptage est similaire au mécanisme vu précédemment.
Pendant la méiose, il y a « réactivation » du X pour la mise en place de l’EGP.
Chez le mâle :
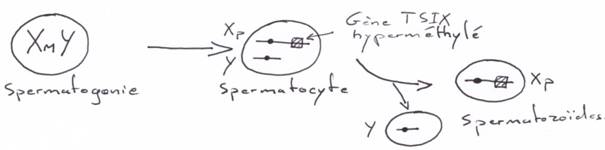
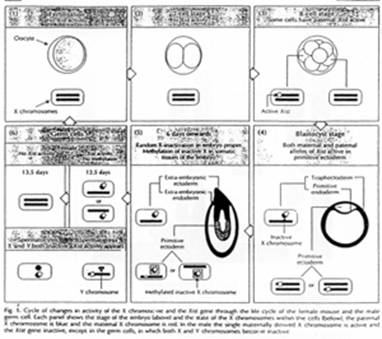
5 La fécondation.
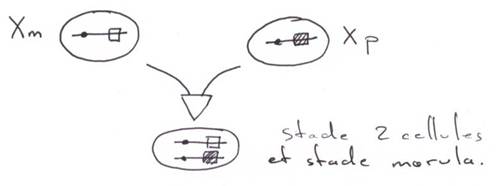
Au stade deux cellules, les gènes zygotiques ne s’expriment pas encore.
Au stade morula (8 cellules), il y aura début de transcription des gènes qui nous intéressent.
Au stade blastocyste, deux mécanismes interviennent : au niveau du trophectoderme, il y a inactivation du X grâce à l’EGP.
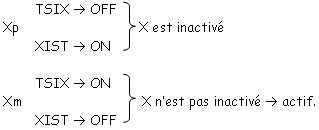
Dans le cas du blastocyste tardif, on a ici une inactivation du X au hasard, après l’effacement de l’EGP.
Dans l’endoderme primaire et les cellules trophoblastiques, voir le cas au-dessus.
Quand XIST est ON, cela entraîne un Xi (inactif) ; quand XIST est OFF, on a Xa (actif).
TSIX régule négativement XIST.
Si l’EGP n’est pas effacée, il y a des problèmes du développement embryonnaire.
V La détermination du sexe chez les mammifères.
Le TDF (Facteur Déterminant la formation du Testicule) est porté sur le bras court du Y. Plusieurs gènes ont été supposés être ce TDF : HY (avec des essais sur le bras court uniquement), puis ZFY (mais ZFY est absent chez les marsupiaux, donc ce n’est pas ça).
Les caractéristiques du TDF :
- Il doit se trouver sur le Y de tous les mammifères,
- Il doit être dans le segment chromosomique déterminant le sexe,
- Il doit être absent ou modifié chez un individu XY de phénotype femelle,
- Il doit être exprimé pour permettre la différenciation testiculaire.
SRY a été identifié et localisé en 1990. On parle de SRY chez l’Humain et de Sry chez la souris. SRY : Région du Y déterminant le Sexe.
On a utilisé un transgène pour vérifier que c’était bien SRY qui correspondait au TDF. On a pu isoler un fragment d’ADN de 24 à 25kB (séquence identique chez l’Homme et la souris).
Les souris transgéniques réalisées avaient un caryotype XX avec le gène supposé être le TDF –> Souris XX-Sry+ : c’étaient des souris avec des gonades mâles (testicules).
On trouve ailleurs des cas « intéressants » chez des individus XX mâles ou XY féminins, etc.… Ces individus ont permis d’isoler la séquence de 24kB portant SRY.
A Relations génotypes/phénotypes.
Le 1er cas est celui d’un mâle normal, XYSRY+.
On peut ensuite trouver un mâle XX. En réalité, cet individu n’a pas SRY (cas C). Dans le cas d’un individu mâle XX-SRY-, il va y avoir une mutation d’un gène porté par le X (DAX1).

Les gènes mâles spécifiques s’expriment si les produits de « Z » sont inhibés par SRY. SRY est monoexonique. C’est une protéine faisant 233 acides aminés. SRY possède une boite de fixation à l’ADN (boite HMG : High Mobility Group). Cette boite provoque une courbure de l’ADN : c’est un facteur de transcription.
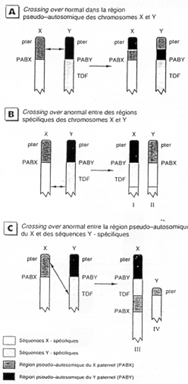
En A, on a un cas normal.
En B, on observe un crossing-over en dehors de la région pseudo-autosomale. Le gène SRY se retrouve sur le chromosome X (X-SRY+ et Y-SRY-).
En C, on a un crossing-over très inégal où SRY se retrouve sur X.
Dans le cas d’un individu femelle XY-SRY+, il va exister des mutations ponctuelles, toutes localisées dans la boite HMG.
Il existe également le cas d’individus XY qui présentent une duplication de XP21. SRY est présent. Cette duplication d’une région du chromosome X entraîne l’expression de DSS (–> DAX1) Dosage Sensitive Sex reversal.
Dans le cas des femelles XY-SRY+, le gène Sry donne un produit anormal ou pas de produit du tout : les gènes mâles spécifiques sont donc réprimés.
Normalement, le sexe génomique est responsable du sexe gonadique (du phénotype de l’individu).
1 Cas « normaux » de l’espèce humaine.
On prend une femme (XX). On suppose qu’elle possède un gène (Z) qui est porté par un chromosome X. Le produit de Z est responsable de la répression des « gènes mâles » spécifiques.
Chez un homme normal, l’action de Z est contrée par la protéine Sry.
2 Cas présentant des anomalies sur les hétérochromosomes.
- Femmes XY : il y a mutation sur Z, de sorte que Sry ne puisse plus contrer les produits de Z. Les gènes mâles spécifiques sont inhibés.
- Hommes XX : les produits de Z ne se fixent pas : il y a répression des gènes mâles spécifiques.
- Les individus X0 : ils présentent un développement des ovaires.
- Cas de Xp21 : il y a duplication de la zone Xp21 du bras (sur le bras court). Ceci provoque une ambiguïté sexuelle ou une réversion totale. On observera un phénotype femelle.
3 Cas mettant en cause un gène porté par un autosome.
Les gènes pouvant intervenir dans la différenciation sexuelle « normale » sont des gènes appartenant à la famille SOX (SRY HMG box containing). Ils codent pour des protéines non histones de la chromatine. A l’heure actuelle, on connaît une vingtaine de gènes SOX.
- SOX9 : quand ce gène est muté, il est responsable de campomélisme (ou dysplasie campomélique) : anomalies osseuses, cartilagineuses et inversion sexuelle. Il y a une homologie d’environ 50% entre les boites HMG SOX9 et HMG SRY.
- SOX3 : il est porté sur le bras long du chromosome X. Les boites HMG SOX3 et HMG SRY ont une homologie d’environ 74%. On pense que SOX3 et SRY dériveraient d’un ancêtre commun. SOX3 s’exprime dans les crêtes génitales, comme SRY, mais aussi dans d’autres tissus, comme le cerveau (cellules nerveuses).
Remarque : en général, les gènes cibles des protéines SOX sont inconnus. Dans le cas de SOX2, on connaît la cible. Il s’exprime notamment au niveau du cristallin.
B Différenciation sexuelle.
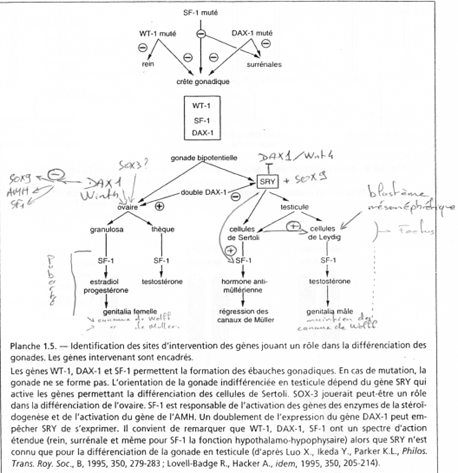
Si SF1 est muté, les surrénales et les crêtes génitales ne se forment pas. Si WT1 est muté, il n’y a développement, ni des reins, ni des crêtes génitales. WT1 : sur le bras long du chromosomes 11 humain. SF1 : sur le bras long du chromosome 9 humain. DAX1 : sur le bras court du chromosome X humain. SOX3 : localisation ? Fonction précise ?
Chez les vertébrés, la gonadogenèse implique l’activité de gènes régulateurs de la différenciation sexuelle, mais aussi, l’action de certaines hormones participant à la formation et au développement des organes sexuels à partir d’ébauches « neutres ».
1 La formation des gonades.
a Les crêtes génitales.
Les ébauches apparaissent sous la forme de deux invaginations de la somatopleure initiale, de part et d’autre du mésentère dorsal.
Il va y avoir un épaississement et un creusement de l’épithélium coelomique.
Dans l’embryon humain, les crêtes génitales se forment au stade neurula âgée (4 semaines) sur la bordure interne du mésonéphros. Les premières ébauches sont dépourvues de cellules germinales. Les gonocytes primordiaux colonisent les crêtes vers 6 semaines. Dès la troisième semaine, les gonocytes sont repérables dans l’embryon.
Les cellules primordiales migrent le long du mésentère dorsal de l’intestin postérieur vers les crêtes génitales. Elles sécrètent un facteur chimiotactique : le GDF9 (famille TGFß).
On est au stade des gonades indifférenciées qui dure un certain temps.
Pendant la colonisation par les gonocytes, l’épithélium coelomique prolifère : il va former les cordons sexuels primitifs.
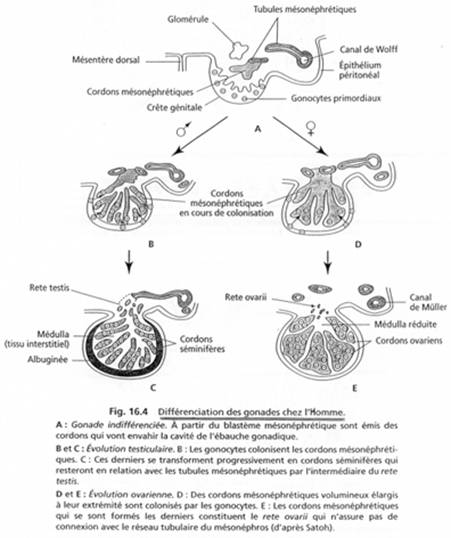
Les cellules épithéliales vont entourer un certain nombre de gonocytes. Dans les deux sexes, ces cordons sont en relation avec la surface épithéliale.
b Evolution testiculaire.
Si l’individu est XY, les cordons sexuels primitifs vont continuer de proliférer et envahir la médulla de la gonade. Ils forment les cordons de la gonade. Ces cordons vont perdre leur connexion avec le cortex ; ils s’étirent en profondeur, jusqu’au hile de la gonade.
Entre les cordons et le cortex se glisse une couche épaisse de mésenchyme qui deviendra l’albuginée.
Le cortex involue car les gonocytes sont tous passés dans les cordons testiculaires médullaires.
Vers le 4ème mois, les cordons testiculaires prennent l’aspect de anse dont les extrémités se rapprochant donnent les tubes droits. Pendant la vie fœtale, on ne parle que de cordons testiculaires (ils ne sont pas encore creusés).
Les gonocytes primordiaux, entourés de cellules de soutien donneront les cellules de Sertoli.
Les cordons restent pleins jusqu’à la puberté. Là, ils vont se creuser et devenir les tubes séminifères. Ils se connectent également au Rete testis. Les canalicules de ce Rete testis s’accrochent aux tubules mésonéphrétiques et donnent ainsi les canaux efférents. Ces canaux vont rejoindre le canal de Wolff qui donnera le canal déférent.
Les cellules de Leydig apparaissent avant les tubes séminifères. Elles sont abondantes entre 4 et 6 mois de gestation. Elles forment le tissu endocrine du testicule.
c Evolution ovarienne.
Les cordons sexuels primitifs se fragmentent en amas dans la zone médullaire. L’épithélium gonadique reste épais et continue à proliférer.
Il se passe une nouvelle poussée de cordons sexuels secondaires (ou corticaux). La région corticale prolifère. Ces cordons vont se détacher légèrement puis se fragmenter.
Les ovogonies se divisent par mitose et entrent vite en prophase 2 de méiose. Cette entrée en méiose s’accompagne d’un « encerclement » de cellules venant de l’épithélium coelomique (les cellules folliculaires). Les follicules primordiaux sont dans la région corticale.
Les cellules folliculaires vont ensuite s’entourer de cellules issues du mésenchyme mésonéphrétique (les cellules médullaires) qui donneront les thèques.
Les gonoductes présents sont :
- Le canal de Wolff (qui donnerait les spermiductes chez un mâle) ;
- Le canal de Muller qui donnera un oviducte chez la femelle.
L’évolution de ces canaux est en relation avec les cellules permettant la néphrogenèse.
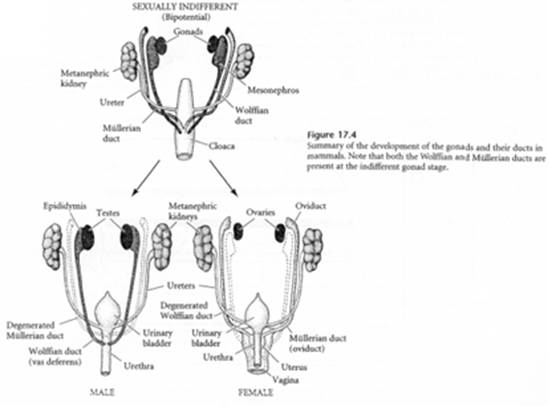
Au début, on a la coexistence et du canal de Muller et du canal de Wolff. Ils auront par la suite des évolutions distinctes.
- Chez le mâle, les cellules de Sertoli sécrètent une hormone anti-Mullerienne (AMH). C’est une lipoprotéine homodimérique avec des cystéines (qui permettent la formation de ponts di-sulfures entre les 2 sous unités). Les cellules de Leydig sécrètent tôt la testostérone qui permet de maintenir les canaux de Wolff et de les faire évoluer en canal déférent, vésicule séminale…
- Chez la femelle, il n’y a pas de synthèse d’AMH (sinon, à un taux insignifiant) ni de testostérone : les canaux de Wolff dégénèrent alors que ceux de Muller persistent.
d La gonade bipotentielle.
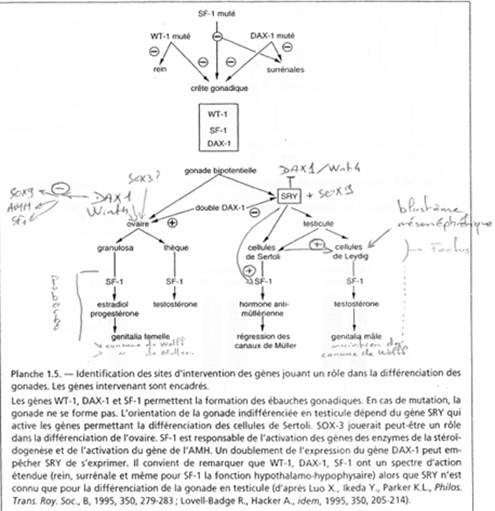
Le cas des mâles.
Il y a expression de SRY et de SOW9 avant la différenciation des cellules de Sertoli (cellules pré-Sertoliennes). Les cellules du blastème mésonéphrétique sont induites par les cellules de Sertoli en cellules de Leydig. Les cellules de Sertoli expriment le gène SF1 dont le produit a pour cible un récepteur nucléaire.
Chez le mâle, ceci a lieu au stade fœtal ; SF1 est stimulé par SRY (par l’intermédiaire d’un récepteur nucléaire).
Les cellules de Leydig produisent SF1 qui va stimuler les gènes de la stéroïdogenèse, et donc, la synthèse de testostérone. Cette dernière stimule le développement et maintient les canaux de Wolff.
Pour la mise en place des organes externes, la testostérone, sous l’action de 5-alpha-réductase, est modifiée en 5-diHydroTestostérone (5dHT). C’est cette dernière qui favorise la mise en place des organes génitaux externes mâles.
Le cas des femelles.
Revoir le schéma précédent
DAX1 stimule la formation de l’ovaire. Comme chez le mâle, SF1 s’exprime. A la puberté, SF1 va stimuler la stéroïdogenèse qui aboutira à la synthèse de progestérone et d’oestradiol.
Remarque : On a prouvé chez la souris que Wint4 était nécessaire à la différenciation ovarienne. S’il est délété ou muté, on observera une différenciation testiculaire.
2 Rôle du X sur l’expression de SRY.
Les travaux de Fregdor ont confirmé ses hypothèses sur le lemming (Myopus schisticolor). Il existe chez ces animaux 3 types de caryotypes femelles : XX, X*X et X*Ysry+.
X* est un X résultant de l’inversion du bras court du X avec une mutation qui réprime l’effet masculinisant de Y.
La non disjonction des XX au moment de la méiose a une fréquence assez élevée dans cette espèce.
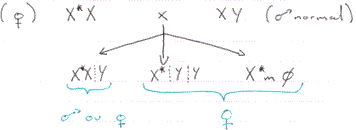
Dans le cas de X*XY, tout dépend du X qui sera inactivé :
- X* est inactivé : on a XY : phénotype mâle.
- X est inactivé : on a X*Y : phénotype femelle.
Remarques :
- On ne connaît pas le déterminant sexuel dans le déterminisme de type Abraxas (ZW) Sox3 est tout de même présent.
- Contrairement à la drosophile où la différenciation sexuelle est mâle par défaut, il n’y a pas de sexe par défaut chez les mammifères.
Le facteur de transcription Gata.
Le facteur Gata4 est impliqué dans l’hématopoïèse (chez la drosophile comme chez l’Homme). Sa structure est très conservée.
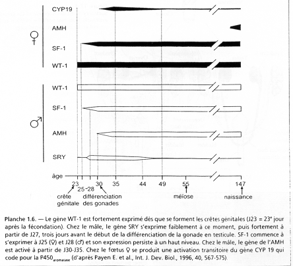
- (A) : Sox9 se lie à l’ADN (sur le promoteur du gène codant pour l’AMH). La synthèse est minimale (basale).
- (B) : Plus tard, SF1 se fixe sur le promoteur avec Wt1 (sur SF1). Ce complexe permet une transcription active.
- (C) : L’intervention de Gata4 est finale et rend très active la transcription d’AMH.
Remarque : l’inversion sexuelle par SOX9 se fait avec une mutation ponctuelle dans l’enhancer du gène codant pour SOX9.
Dans le fœtus mâle, après quelques semaines, il y a une forte sécrétion de testostérone par les cellules de Leydig. Elles sont stimulées (et leur libération de testostérone également) par l’HCG libéré par le trophoblaste. Il va ainsi y avoir une imprégnation des centres nerveux par la testostérone. Ceci permet de donner le sexe psychique (social) à l’individu.
Aucun commentaire jusqu'à présent.