Sexualité – Reproduction :
Chapitre 1 : Lignée germinale et Gamétogenèse.
Télécharger le document sur le serveur FTP ou sur le serveur web (HTTP).
I Introduction.
A Définitions.
Sexualité : mécanismes cellulaires de différenciation sexuelle.
Multiplication asexuée : formation de clones (par exemple, les bactéries).
Reproduction sexuée : gamètes mâle et femelle qui vont se recombiner.
Remarque : chez les bactéries, il existe une reproduction sexuée par envoi de l’épisome (une partie du génome) d’une bactérie HFr (ou mâle) dans une bactérie F- (ou femelle). Il y a recombinaison et formation d’un génome original.
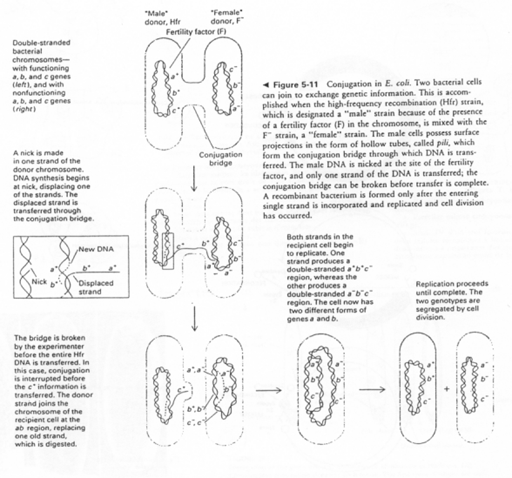
On voit les différents mécanismes permettant de faire passer (transmettre) des mutations à la descendance : c’est un facteur d’évolution de la reproduction sexuée.
B Sexualité, méiose et système reproducteur.
Pour les organismes supérieurs, il y a utilisation de la méiose afin de former des cellules haploïdes.
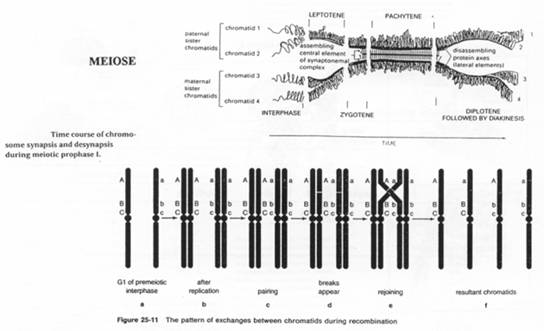
Le phénomène de crossing-over va intervenir dans la recombinaison. Il y a formation d’individus différents et aussi des combinaisons de mutations (Fav/Fav ou Défav/Défav en Fav/Défav).
Remarque : le problème de chromosomes supplémentaires concerne le phénomène de translocation.
La méiose est un phénomène nécessaire pour assure la diversité mais elle peut causer des problèmes.
Les complexes synaptonémaux : ce sont des appariements de chromosomes, base à base : cela forme très souvent des barrières entre les espèces.
Les cycles haplobiontiques, diplobiontiques et haplodiplobiontiques.
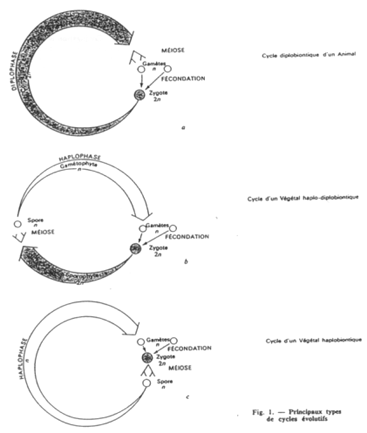
Les différences entre cycles proviennent de l’importance (de durée) des phases. On trouve des différences selon les espèces.
Les gamètes viennent de précurseurs diploïdes (les gonocytes primordiaux). Ceux-ci peuvent se localiser en différents endroits. Ces endroits peuvent être différents du lieu de différenciation.
Ces précurseurs germinaux primordiaux (formant une population cellulaire et non un tissu) se différencient pendant le développement embryonnaire précoce. Toujours durant le développement, ils migrent ensuite vers les ébauches des organes génitaux.
Une fois arrivés, les précurseurs germinaux primordiaux se multiplient par mitose et donneront des ovogonies/spermatogonies.
Cas de l’espèce Humaine :
c’est une espèce anisogame à organismes gonochoriques.
Dans les ovaires, il y a croissance des gamètes (développement+croissance).
Pour les gamètes mâles, on ne retrouve presque plus de cytoplasme (pas de réserves). Il n’y a que les « outils » pour le déplacement et la pénétration des spermatozoïdes dans l’ovule.
Autres cas :
- Hermaphrodisme : il y a moins de dépenses énergétiques pour la reproduction grâce à l’autofécondation mais la fécondation croisée est souvent nécessaire.
- Parthénogenèse : on peut citer l’exemple des abeilles. Ici la fécondation par les spermatozoïdes n’est pas tout le temps obligatoire.
La reproduction sexuée présente de nombreux avantages mais elle est biologiquement chère. Toutefois, la loterie génétique permet une adaptation rapide.
II Les cellules germinales et leur saga.
A Introduction.
Les gamètes haploïdes sont produits à partir de gonocytes primordiaux (qui sont différents des cellules somatiques).
Dans le cytoplasme de ces cellules, il existe une coloration différente, mais l’on retrouve aussi : plus de mitochondries et de granules ribo-nucléo-protéiques. Un granule ribo-nucléo-protéique est la phosphatase alcaline.
Les gonocytes présentent une taille importante. Ils se divisent peu pendant la gastrulation (ils ne forment pas de tissu).
Une fois qu’ils ont migré, les gonocytes vont former les gonades : les cellules sont attirées par chimiotactisme par les crêtes génitales et y subiront une différenciation:
- Prolifération (pour atteindre la masse critique),
- Réalisation de la méiose (ce sont les seules cellules à pratiquer ce type de division).
Les gonocytes primordiaux sont immortels : ils ne peuvent pas subir la mort par sénescence. Ils possèdent des télomérases qui compensent la dégradation des télomères.
Remarque : on retrouve ces télomérases dans les cellules embryonnaires, durant le développement embryonnaire.
B Ségrégation Soma/Germen.
Cas du nématode : Parascaris equorum.
Dès le stade 2 cellules, on peut distinguer deux lignées (une somatique / une germinale).
Les déterminants maternels sont primordiaux pour cette différenciation.
Cas de la souris, mammifère.
Jusqu’au stade morula, toutes les cellules peuvent avoir tous les devenirs. Il y a des besoins d’interaction cellulaire pour le développement des lignées.
Les premières cellules de la lignée germinale apparaissent à 7,5 jours.
Cas de « Dolly », clone de mammifère.
Il y a formation de cellules germinales à partir de cellules somatiques.
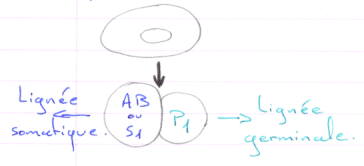
Cas d’Ascaris.
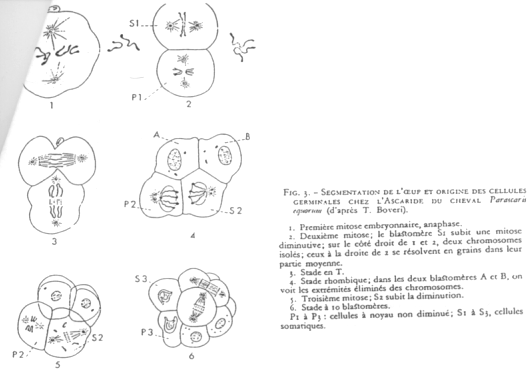
En 1 : le zygote. En 2 : 1er clivage horizontal.
La cellule S1 voit ses chromosomes qui subissent une diminution chromosomique.
S1 vers A-B par clivage vertical (chromosomes diminués)
P1 vers P2+S2 (S2 verra son noyau diminuer). Les cellules Px héritent de la partie végétative.
On a un lignage Px où le noyau est entier. Les autres lignées ont un noyau diminué.
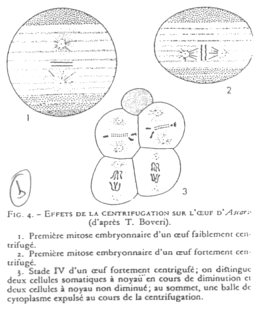
On centrifuge des œufs d’Ascaris. On change ainsi l’axe du fuseau de division et les deux cellules ont leur noyau préservé.
Il y a une détermination germinale par le cytoplasme avec les déterminants végétatifs.
Le « plasme germinal » est ce qui permet de donner la différenciation de la lignée germinale.
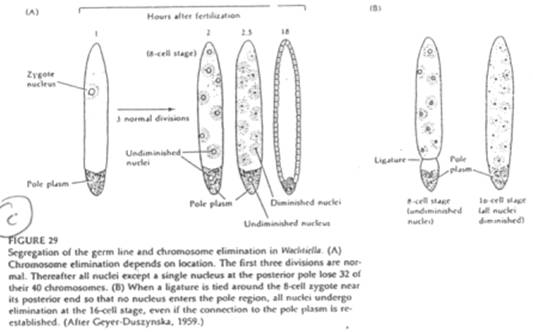
Cas de Wachtiella.
Le développement de cet animal est comparable à celui de la drosophile. On trouve ici un plasme polaire avec de nombreuses mitochondries et de nombreux granules.
Les noyaux du plasme postérieur sont protégés de la diminution chromosomique.
Cas de la Drosophile.
Ici, il n’y a pas de diminution chromosomique mais le plasme germinal postérieur existe toujours. C’est aussi le cytoplasme qui permet la différenciation de la lignée germinale.
Cas des Amphibiens.
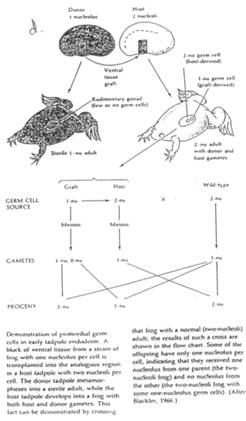
La zone végétative, ventrale, contient les cellules de la lignée germinale. Si l’on irradie cette zone germinative de la blastula, on obtiendra des individus stériles.
C Plasme germinal et déterminants germinaux.
Les cellules germinales sont souvent associées aux tissus endodermiques, indispensables à la formation des cellules polaires (germinales primordiales).
Pendant l’ovogenèse, chez la Drosophile, il y a différenciation du cytoplasme postérieur par stockage de Granules ribo-nucléo-protéiques.
On voit l’intervention de microtubules pour réaliser le déplacement des granules et des ARNm.
– La Kinésine permet un déplacement vers le pôle + ; – La Dynéine permet un déplacement vers le pôle -.
Le messager Oskar est transcrit dans les cellules nourricières. Il va se localiser dans la partie postérieure. Il s’ancre ensuite dans le cytosquelette cortical d’actine grâce à la protéine Vasa.
Oskar et Vasa forment les premiers granules ribo-nucléo-protéiques.
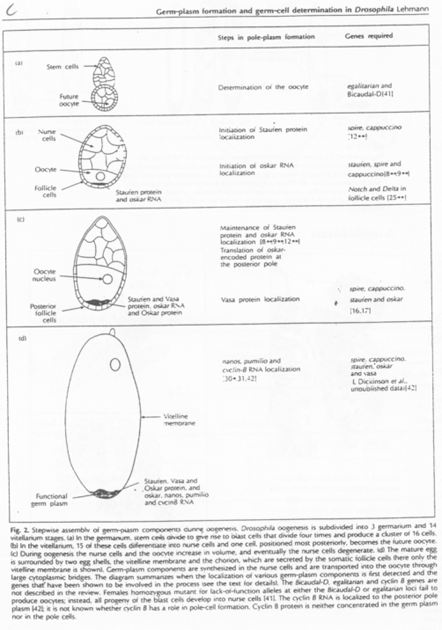
D’autres messagers comme Valois, Tudor, vont constituer les autres molécules qui interviendront dans cette différenciation.
Quand les cellules nourricières se déversent dans l’ovocyte, Nanos et Germ-cell-less y sont également propulsés. Ils vont migrer sur des microtubules vers la partie postérieure. Ils finissent par s’y ancrer grâce aux molécules déjà présentes.
Il y a ensuite ponte puis fécondation…
Si l’on irradie la partie postérieure du zygote juste pondu, il y aura stérilité par dégradation des ARNm. Si à la même place, on injecte Germ-cell-less, on récupèrera
un peu de cellules germinales.
Ces cellules possèdent de nombreuses mitochondries. Des ARN mitochondriaux sont produits, dont le Mt-L-rRNA (Mitochondrie Large ARNr) qui est très majoritairement associé aux cellules polaires.
L’injection de Mt-L-rRNA dans le plasme germinal va entraîner la formation de cellules polaires, mais pas de cellules germinales.
Mt-L-rRNA intervient dans la ségrégation cellulaire.
Les Mt-L-rRNA s’associent avec un MTOC (centre organisateur des microtubules) et donnent un côté qui va suivre la voie germinale (l’autre coté, non) avec une division asymétrique.
Chez les amphibiens, la ségrégation est asymétrique pendant le début des divisions (de 8 à 64 blastomères). Les cellules germinales récupèrent des fragments de cytoplasmes spécifiques.
D Migration des cellules germinales.
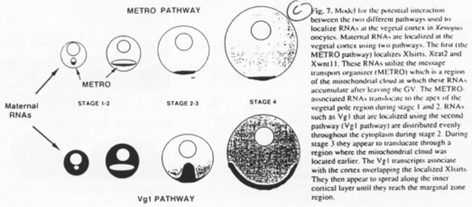
Pendant l’ovogenèse, les ARNm se stockent dans la partie végétative avec les mitochondries.
Il va ensuite y avoir divisions puis migration vers les gonades.
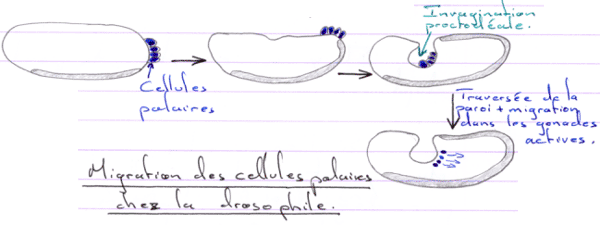
La migration est un mécanisme passif, sauf pour la sortie où le phénomène est actif. Les gonades en développement synthétisent des substances chimiotactiques.
Cas des Amphibiens.
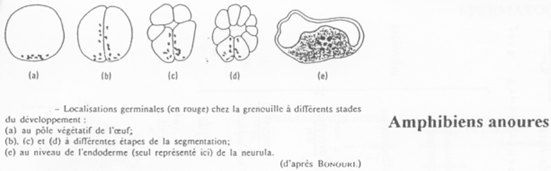
On retrouve ici des granules ribo-nucléo-protéiques mais aussi des équivalents de Vasa (et également chez les mammifères). Quand la gastrulation commence, les cellules germinales se divisent peu et se mettent à migrer.

Cas des Oiseaux.
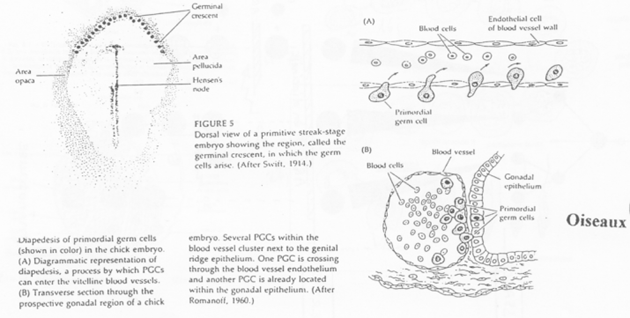
Au niveau des îlots sanguins, on note la présence d’hémangioblastes formant un appareil circulatoire.
Le croissant germinal contient les cellules primordiales germinales.
Ces cellules primordiales germinales entrent dans les vaisseaux en cours de formation et sortiront par diapédèse. Un chimiotactisme est exercé par les gonades.
Cas des Mammifères.
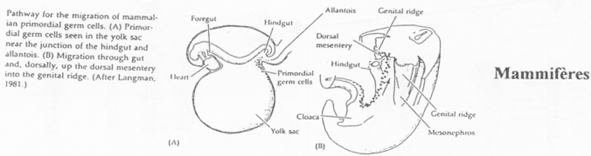
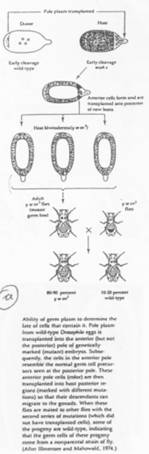
Chez la souris, les cellules primordiales germinales apparaissent tardivement (vers 7 jours et demi). Elles vont synthétiser des molécules semblables aux déterminants maternels de la drosophile.
L’endoblaste envoie des signaux vers l’épiblaste (BMP2, BMP4) qui vont modifier les cellules qui les captent (les cellules primordiales germinales).
Ces cellules primordiales germinales vont se rassembler au niveau de l’allantoïde, passer dans le tube digestif, remonter celui-ci pour atteindre les crêtes génitales.
Les restes des extensions cytoplasmiques des premières cellules primordiales germinales servent de « fil d’Ariane », de route, pour les cellules primordiales germinales suivantes.
Au cours de la migration des cellules primordiales germinales, ces cellules vont se diviser car elles sont déterminées. Leur prolifération sera forte dans les gonades. Elles pourront subir la dégénérescence puis l’apoptose.
Chez le mâle, 70% des cellules germinales disparaissent par apoptose. Elles reprendront leur développement à la puberté.
Chez la femelle, 30% de ces cellules disparaissent. Leur diminution continuera au cours du temps.
E Différenciation des cellules germinales / Aspects généraux de la gamétogenèse.
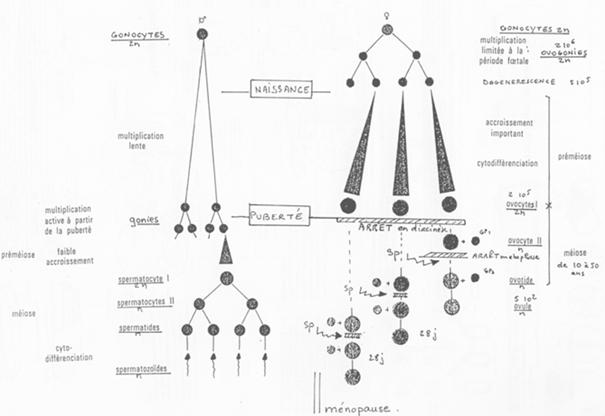
La spermatogenèse est un phénomène continu. L’ovogenèse voit son déroulement interrompu (phénomène discontinu).
La différenciation des cellules germinales fait appel à un processus complexe.
La comparaison des deux mécanisme (spermatogenèse et ovogenèse) se fait selon :
- Le phénomène continu ou discontinu ;
- La taille et la mobilité des cellules ;
- La période de cytodifférenciation.
La cytodifférenciation se déroule avant la méiose dans les cellules germinales femelle et après la méiose dans le cas des cellules germinales mâles.
Les points communs aux deux mécanismes sont :
– La régulation par l’axe hypothalamo-hypophysaire ;
– Les facteurs moléculaires impliqués et les cellules mises en jeu (quasi identiques).
III La spermatogenèse.
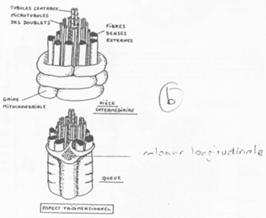
A Description du testicule.
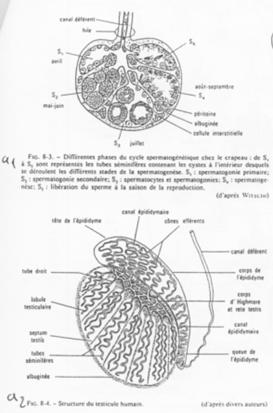
En a1, on voit l’organisation d’un testicule d’amphibien. En a2, on se trouve dans le cas de l’Homme, mammifère.
Dans ce dernier cas, le testicule est constitué de lobules séparés les uns des autres par des septa testis.
Dans chaque lobule, les tubes séminifères sont serrés, denses.
La zone de production des spermatozoïdes est coiffée par l’épididyme.
Le tissu conjonctif du testicule regroupe les cellules de Leydig.
Le testicule est un organe endocrine et exocrine gamétogène.

Dans l’épididyme, les spermatozoïdes seront modifiés pour devenir efficaces. Ils vont ensuite être stockés dans la partie large du canal déférent.
Chez les amphibiens mâles, dans chaque cyste, toutes les cellules sont au même stade de développement. Les stades dépendent des saisons.
B Cinétique de la spermatogenèse.
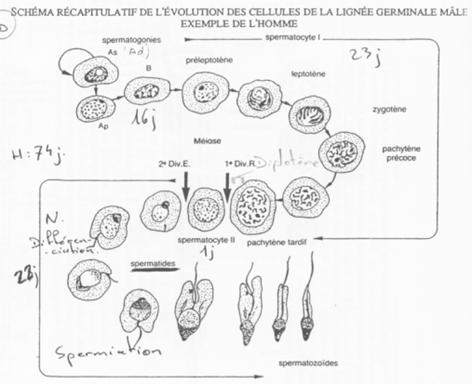
Les spermatogonies (2N) sont en nombre faible. Elles vont se diviser asymétriquement et donner :
– Des spermatogonies souches (Ad) ;
– Des spermatogonies qui évolueront en spermatozoïdes (Ap).
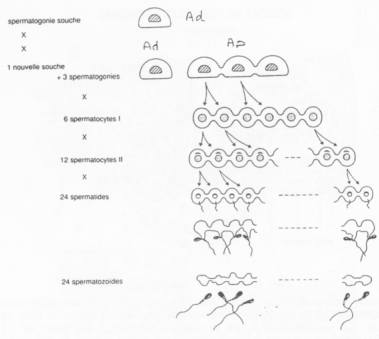
La cytodiérèse des cellules Ap est incomplète : les cellules sont reliées par des ponts cytoplasmiques.
Le stade pachytène.
La cellule B donne des spermatocytes 1 qui vont entrer en méiose (prophase I).
Il va y avoir appariement des bivalents grâce à des complexes synaptonémaux chez les espèces qui les possèdent.
On aperçoit une vésicule germinative ; les chromosomes X et Y (deux par paires) vont se condenser afin d’éviter une recombinaison accidentelle.
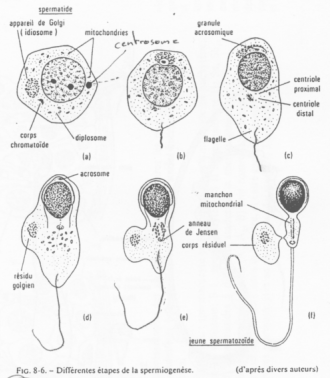
On peut observer de nombreuses mitochondries périphériques (autour du flagelle).
En a et b, on trouve, à l’opposé du flagelle, l’idiosome (le Golgi). Le centrosome est du côté du flagelle. Le Golgi permet la production des vésicules pro-acrosomiques.
En c, c’est la phase de « Cap » : fusion des granules pro-acrosomiques en une seule. On obtient une grosse vésicule qui vient se coller au noyau et modifier l’enveloppe nucléaire qui est à son contact.
En d, cette coiffe s’étend et recouvre encore plus le noyau. Ce dernier va être modifié.
La polarisation est maintenant poussée. Le noyau se colle contre l’acrosome ; le flagelle pousse ; le cytoplasme se réduit ; les mitochondries se rassemblent autour du flagelle.
En e, f, le cytoplasme va être éliminé.
On observe un « manteau » de mitochondries autour du flagelle.
L’acrosome :
Il contient des granules pro-acrosomiales qui renferment des enzymes permettant la lyse de multiples objets (action protéolytique, de dégradation).
Le noyau du spermatozoïde : Il est hyper condensé, de structure presque cristalline. Cette modification de condensation vient du remplacement d’histones par des protamines.
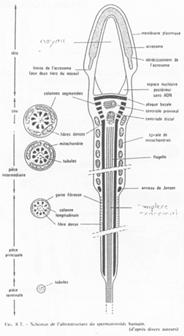
Fonctionnement du flagelle.
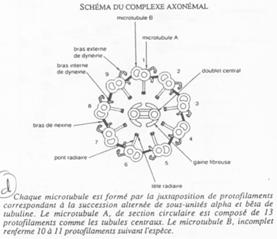
On trouve 9 doublets de microtubules AB :
- 13 protofilaments A ;
- 10 protofilaments B ;
- Un doublet central (2×10).
Un bras de nexine permet de relier les doublets entre eux. Un pont radiaire vient, lui, mettre en relation les doublets externes au doublet central.
La dynéine vient donner le mouvement au flagelle (Cf. BGU10).
Etude de tubes séminifères.
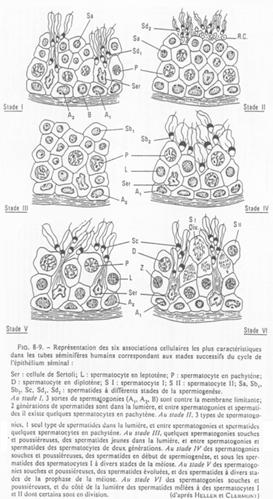
Les différents stades s’organisent selon 6 combinaisons. Tous les 16 jours, une spermatogonie s’engage dans la différenciation.
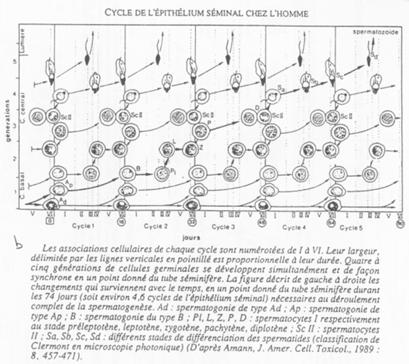
On peut donc définir une onde spermatique avec 6 combinaisons cellulaires possibles.
C Expression génique au cours de la spermatogenèse.
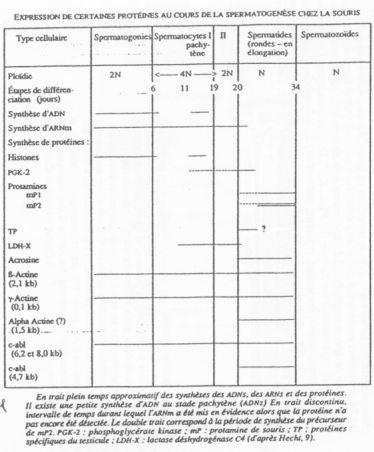
Il y a expression typique de molécules à des moments donnés, nécessaires.
On retrouve l’existence d’isoformes d’enzymes de cellules somatiques.

Il y a existence de gènes tissus-spécifiques ainsi que d’isoformes selon le groupe de cellules germinales/de cellules somatiques.
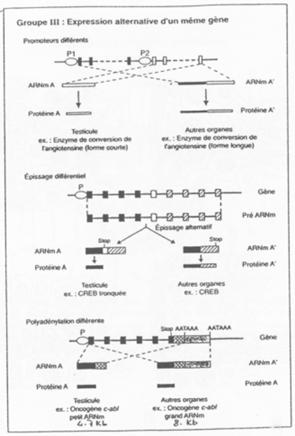
Il y a expression alternative d’un même gène.
D Contrôle de la fonction testiculaire : cellule de Leydig et de Sertoli / Maturation des spermatozoïdes.
Les cellules de Sertoli sont au milieu des cellules germinales en cours de différenciation.
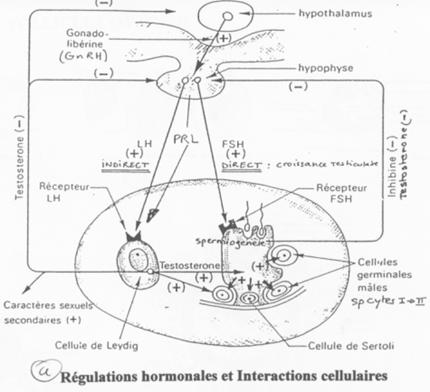
L’action de la FSH est de provoquer une stimulation du testicule en ciblant des récepteurs à 7 segments transmembranaires.
L’action de la LH est d’être captée par les cellules de Leydig et de provoquer alors l’activation de l’Adenylyl cyclase (et donc la synthèse d’AMPc).
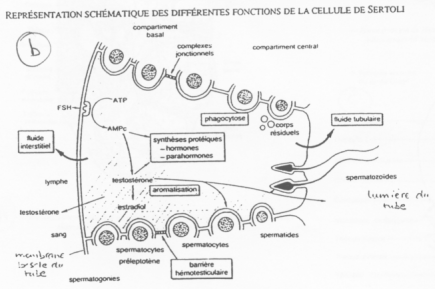
Les cellules de Sertoli créent des compartiments où la spermatogenèse se produit.
Entre deux spermatogonies, il y a formation d’une barrière hémato-testiculaire grâce à des jonctions étanches.
La barrière s’ouvre pour laisser entrer les spermatogonies. Le passage de la barrière se fait quand la méiose débute (réplication de l’ADN). Du côté du sang, on trouve des cellules à 2N alors que du côté du testicule, on trouve des cellules à N. Les cellules de Sertoli régulent la spermatogenèse et les spermatogonies renvoient le message aux cellules de Sertoli.
Cellules de Leydig –> Cellules de Sertoli –> Cellules Germinales.
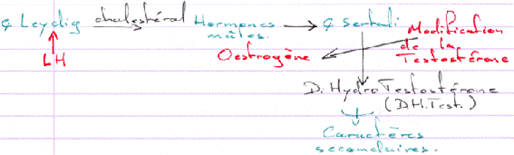
Les facteurs produits par les cellules de Sertoli vont activer les spermatogonies mais aussi aller réguler le reste du contrôle de différenciation.
La dH-Testostérone a un rôle dans la différenciation de l’épipidyme.
L’Hormone Anti-Mullerienne, de la famille TGFß, sert à la mise en place des organes mâles.
IV L’ovogenèse.
L’ovogenèse est un processus discontinu.
Dans les gonades, les ovogonies vont se multiplier. Elles vont entrer en phase d’accroissement de taille (préméiose) ou phase de cytodifférenciation.
Il y a ensuite un blocage. Le développement reprend à la puberté où l’on a maturation d’un ovocyte tous les 28 jours puis ovulation. L’ovule libéré est bloqué en ovocyte 2 (métaphase 2).
A Ovaire et follicule ; contrôle hormonal de l’ovogenèse.
Représentation théorique d’un ovaire de mammifère.
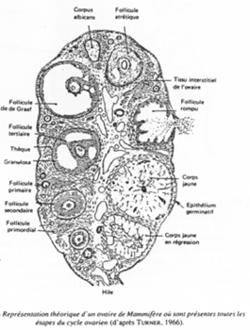
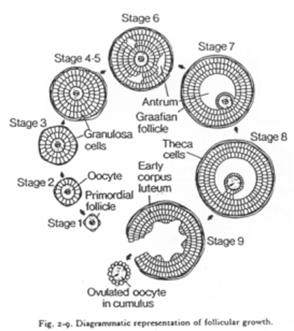
C’est un organe complexe où les ovocytes s’organisent en follicules primordiaux accompagnés d’une sorte de « cocon ».
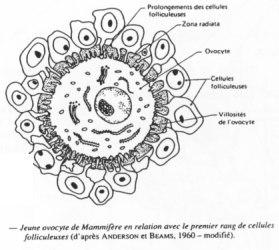
Un follicule primordial = ovocyte + cellules folliculaires.
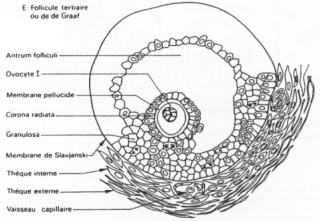
Un follicule de « De Graaf ».
Ici, l’ovocyte est entouré par les cellules de la granulosa. La membrane basale est appelée membrane de Slajvanski. Le tissu conjonctif est irrigué et forme deux ensembles : la thèque interne et la thèque interne.
L’ovocyte repose sur l’atrium folliculi.
Les cellules qui accompagnent l’ovocyte lui permettent d’avoir un développement correct.
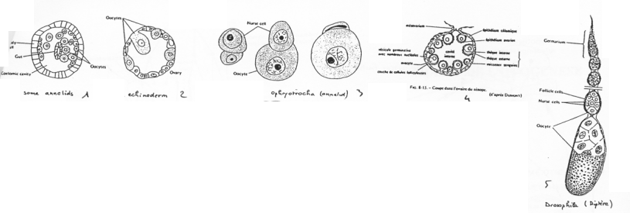
En 1, on a la forme simple. L’ovocyte est produit par délamination dans le coelome.
En 2, un échinoderme. Un ovaire est mis en place mais il reste simple.
En 3, l’ovocyte est associé à une cellule nourricière.
En 4, on est chez l’amphibien. On trouve un organe particulier. On distingue des ovocytes entourés par une couche de cellules folliculaires, d’une thèque et de la
granulosa. Il y a multiplication du stock d’ovocytes pour chaque saison de ponte.
En 5, l’ovariole de drosophile. L’ovariole est constituée des chambres ovariennes et du germarium. An final, dans une chambre, on trouve 15 cellules nourricières et l’ovocyte (1 cellule).
Le contrôle hormonal.
Le contrôle hypothalamo-hypophysaire.
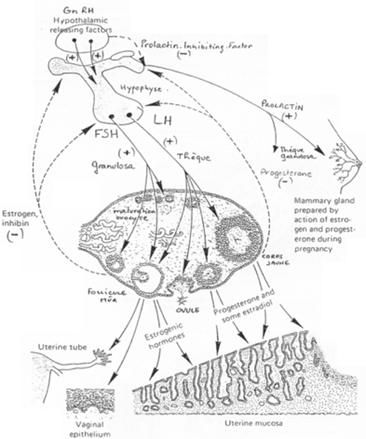
L’hypothalamus libère le GnRH (neurotransmetteur) sur l’hypophyse (antérieure). Il y a alors libération de FSH et de LH. Ces deux hormones vont se fixer sur des récepteurs à 7 segments transmembranaires et provoquer la formation d’AMPc.
– La FSH agit sur la granulosa (« l’épithélium »). – La LH voit son action sur les cellules de la thèque.
Les oestrogènes sont libérés partiellement vers le liquide antrique mais vont également exercer un rétrocontrôle sur l’adénohypophyse.
Il y a, par le rétrocontrôle, inhibition de FSH et activation ou inhibition de LH selon la concentration (pour une concentration inférieure à 200?g/mL de LH, on a inhibition et pour une concentration supérieure, on aura une activation).
L’ovocyte présente de nombreux récepteurs aux hormones et aux facteurs de croissance.
B Les grandes phases de l’ovogenèse.
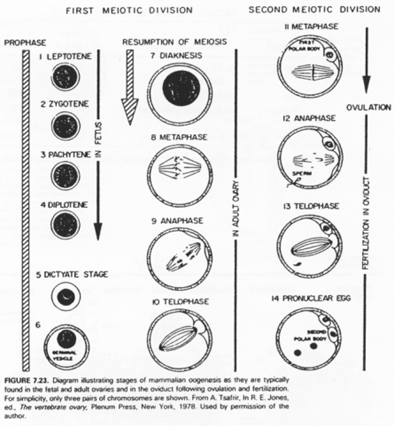
Les cellules germinales sont immortelles par sénescence mais peuvent subir l’apoptose (ce qui permet de réguler leur nombre).

On compare la multiplication cellulaire et l’apoptose chez trois espèces différentes.
Quand un follicule s’engage dans la croissance, un certain nombre de ses semblables va dégénérer (compétition pour poursuivre leur développement) : c’est l’atrésie.
Cette atrésie est une sélection par dominance d’un ovocyte. Le nombre d’ovocytes arrivant finalement en activité (sur une vie) est faible.
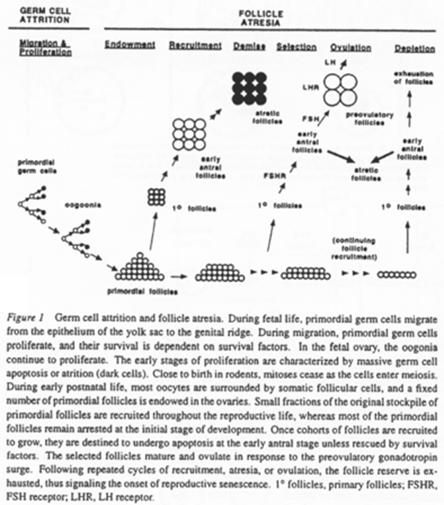
A chaque étape, on note une perte de follicules.
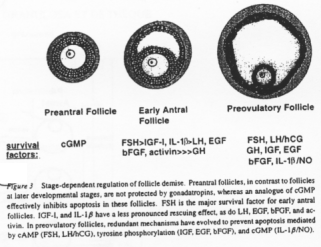
Différents facteurs interviennent pour empêcher les follicules d’entrer en apoptose. Ils peuvent varier selon le stade de développement de l’ovocyte :
- GMPc,
- FSH, LH, IGF1, EGF, FGF…
C Phase d’accroissement / de cytodifférenciation.
L’entrée en prophase méiotique marque le début du déroulement de la phase de croissance.

Il y a un blocage au stade diplotène chez les amphibiens grâce à une grosse accumulation de molécules.
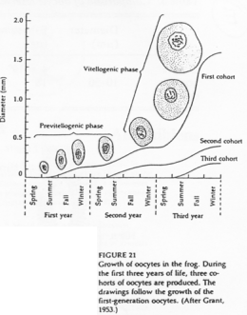
On distingue deux phases : le petit et le grand accroissement. Cette croissance se fait sur trois ans chez Rana pipiens. Deux ans puis un an. On passe, pour l’ovocyte, de 150µm à 1.5mm.
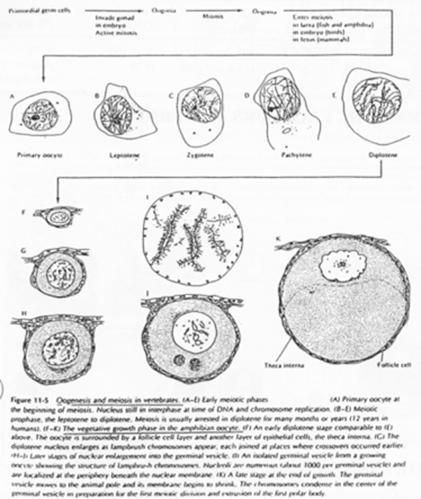
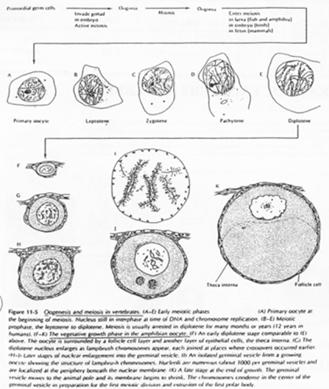
La phase leptotène correspond à la réplication des chromosomes.
La phase Pachytène : noyau diploïde avec des chromosomes étant ancrés sur l’enveloppe nucléaire, au pôle du noyau.
La phase Diplotène correspond à la phase de fort grossissement.
L’ovocyte 1 montre un noyau à organisation particulière avec des petites tâches (les nucléoles). La chromatine des divalents prend une forme en écouvillon (= lampbrush). Les micro-nucléoles servent à l’amplification de l’ARNr.
Dans l’espèce Humaine.
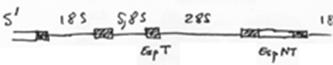
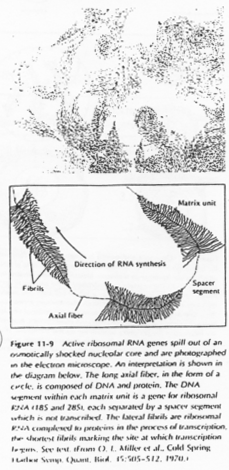
Chez les amphibiens, on trouve environ 300 cistrons chromosomiques. L’amplification (production d’ARN) se fait par rolling circle.
Il y a une production « industrielle » d’ARNr qui sera stockés dans l’ovocyte.
Remarque : Les ARN 5s ne sont pas amplifiés mais ils ont une très bonne efficacité de transcription.
Chez l’Homme, il n’y a pas d’amplification mais les nombreux cistrons existant seront tous utilisés (transcrits), ce qui permet le stockage d’ARN.
Les boucles observées sur l’ADN sont des zones de fortes transcriptions : une importante quantité d’ARN est produite. Ces ARN vont passer dans le cytoplasme pour y être stockés ou bien traduits en protéines qui, elles, seront stockées.
La production d’histones est également très importante.
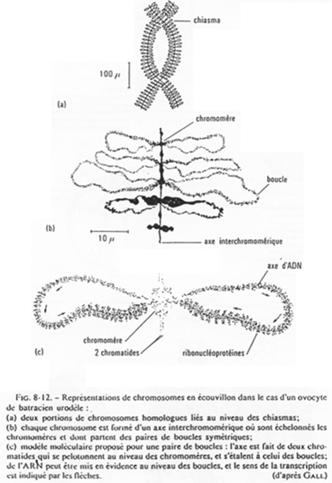
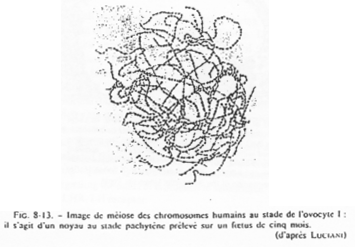
Chez la femme, les chromosomes d’ovocytes n’ont pas la même forme que les chromosomes de cellules somatiques.
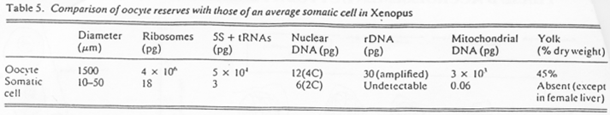
Comparaison des contenus de cellules somatiques avec le contenu de cellules ovocytaires, entre espèces.
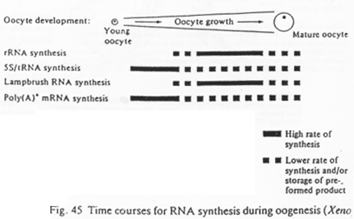
Répartition temporelle de la production de différents d’ARN.
La phase de gros accroissement.
Il y a accumulation du contenu ovocytaire. La majeure partie des molécules nutritives sont produites par le foie maternel et forme le vitellus.
Des oestrogènes de rétrocontrôle sont captés par le foie et déclenchent la production de vitellogénine. Cette molécule est un dimère de 470kDa codé par un ARN unique. Elle entre dans l’ovocyte par micro-pinocytose en lipovitelline et phosphvitine.
Ces deux molécules s’amalgament en plaquettes vitellines. Le vitellus contient des lipides, des protides et des glucides.
Remarques :
- Chez la drosophile, la vitellogénine est à peu près identique et est produite par le « corps gras ».
- Chez les mammifères, il y a un blocage au stade « diplotène avancé ».
- La puberté correspond au relancement de la méiose avec la phase de « gros accroissement » (diacynèse).
- La division méiotique est asymétrique.
/ul>
L’asymétrie de l’œuf.
Pour les amphibiens, l’œuf est anisotrope. Sous la membrane plasmique, on trouve les pigments corticaux qui marquent la partie animale. Les plaquettes vitellines sont principalement retrouvées dans la partie végétative. Les ARN sont plus retrouvés dans le pôle animal mais sont quand même bien présents dans la partie végétative.
L’espace périvitellin est occupé par les pieds des cellules folliculaires et des microvillosités de l’ovocyte. Des granules corticaux vont aussi se disposer en périphérie de l’œuf.

Chez la drosophile, une cellule polaire va donner les cystoblastes, des cellules souches pour l’ovogenèse.
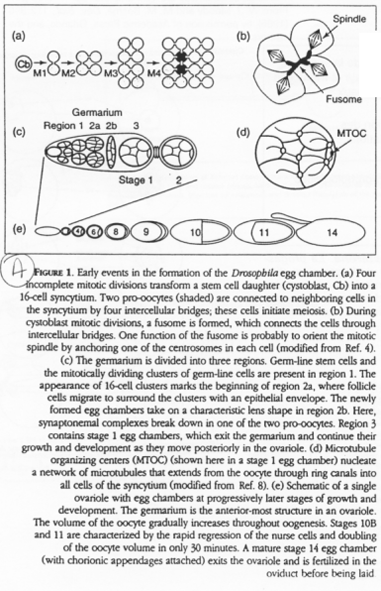
Les cystoblastes (ou cystocytes) se multiplient et donnent 16 cellules (15 cellules nourricières et un ovocyte) qui seront reliés par des ponts cytoplasmiques. Ce réseau ainsi formé par les ponts cytoplasmiques est appelé le « fusome ».
Les messagers migrent sur les microtubules :

La région 3’UTR permet l’adressage en interagissant avec soir la dynéine (vers le pôle -) soit avec la kinésine (vers le pôle +).
Le cas des amphibiens.
On trouve un phénomène comparable à celui de la drosophile.
Les divisions goniales donnent des cystoblastes qui subissent 4 divisions incomplètes : on a 16 cellules accrochées : un cyte.

Le stade diplotène.
Le noyau est central, les chromosomes décondensés. Le centrosome et les mitochondries forment le corps de Baldiani.
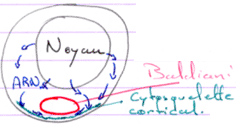
Les ARN produits par le noyau vont, au niveau du corps de Baldiani, se retrouver piégés dans le cytosquelette cortical.
La seconde phase d’accroissement.
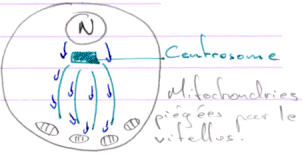
Les ARN sont localisés par les microtubules en fonctions des régions 3’UTR.
Les mitochondries vont être utilisées pour la formation du plasme germinal : elles sont un déterminant de la lignée germinale.
Remarque : chez la souris, il y a également formation d’un cyste à 16 cellules.
La méiose est asymétrique dans l’ovocyte : elle donne l’ovocyte 2 (de très grande taille) et le globule polaire (minuscule).
D Blocage et reprise de la méiose.
Chez la femelle, ce processus est lent (un an environ). Il y a besoin de l’association ovocyte + follicule. Au début, on a le blocage en prophase 1. L’ovocyte n’a subit que le petit accroissement.
Chez les mammifères, le fort accroissement est faible.
– La phase pré-antrique dure environ 300 jours. – La phase antrique dure environ 65 jours.
La phase pré-antrique.
Cette phase n’est pas sous contrôle de la FSH ni de la LH (des hormones hypothalamo-hypophysaires). En réalité, l’ovocyte prépare les cellules folliculaires à répondre aux hormones hypothalamo-hypophysaires. Deux molécules sont importantes dans cette phase : GDF9 et BMP15, toutes deux de la famille TGFß.
Les cellules folliculaires vont grossir, se multiplier (les cellules de la granulosa) : c’est la folliculogenèse. Une fois ces cellules en nombre suffisant, il va y avoir creusement de l’antrum.
La phase antrique.
Cette phase est sous contrôle de la FSH et de la LH.
A ce moment, la prolifération cellulaire continue encore.
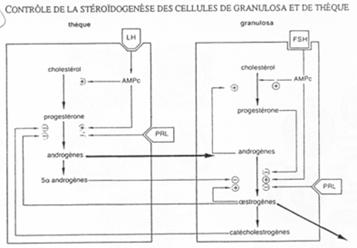
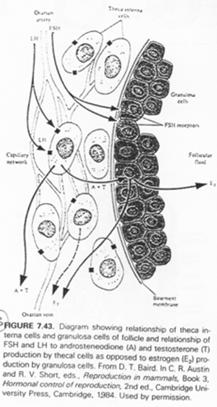
La LH agit sur les cellules de la thèque en induisant la synthèse d’hormones mâles, qui, dans la granulosa, seront aromatisées en hormones femelles (oestrogènes).
La FSH agit sur :
- Les cellules de la corona radiata en provoquant leur multiplication et l’apparition à leur surface de récepteurs ;
- Les cellules de la granulosa ; il y a induction de l’apparition de récepteurs à LH et augmentation des récepteurs à FSH ;
- De nombreux ovocytes en initiant leur développement.
Sur l’ensemble des ovocytes qui se lancent dans la maturation, il va y avoir :
- Recrutement d’ovocytes et de leur follicule ;
- Sélection de l’ovocyte ;
- Dominance d’un ovocyte sur les autres
- Atrophie des ovocytes dominés : il n’en reste qu’un qui pourra suivre sa maturation.
Le rétrocontrôle de FSH agit par :
- Une diminution de la production de FSH (sur l’hypophyse) ;
- Une diminution de la quantité de FSH produite pour de plus en plus de récepteurs à FSH ;
- Le manque de FSH pour tous les follicules : un seul arrive à capter assez de FSH. Ce follicule domine les autres. Les follicules dominés entrent en atrésie.
Le pic de LH, capté par les cellules de la thèque et de la granulosa va provoquer des modifications des relations entre ces cellules et l’ovocyte.
On passe maintenant à la phase de diacynèse.
Pincus a enlevé toutes les cellules folliculaires autour d’un ovocyte, ce qui a provoqué son entrée en méiose.
Chez les mammifères, les cellules folliculaires bloquent le développement de l’ovocyte.
Chez les amphibiens, cette inhibition folliculaire n’est pas observée.
La zone pellucide sépare les cellules folliculaires de l’ovocyte. Des « ;pieds » relient ces deux types cellulaires et forment des jonctions communicantes limitant le passage à des molécules de PM inférieur à 1kDa.
Le pic de LH provoque la libération d’acide hyaluronique par les cellules de la granulosa mais aussi la rupture des jonctions communicantes entre ces cellules et l’ovocyte.
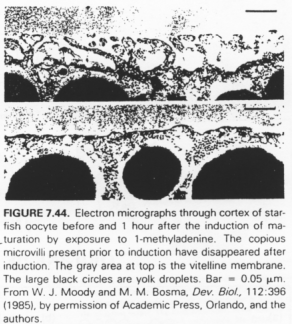
Il y a un changement de morphologie après le pic de LH.
OMI (Oocyte Maturating Factor).
L’OMI est caractérisé par :
- De petits peptides à rôle inhibiteur mais pas total ;
- De l’hypoxanthine (acide nucléique) dont le rôle est important par action inhibitrice de l’AMPc phosphodiestérase (qui dégrade l’AMPc).
L’AMPc est synthétisé dans les cellules folliculaires vers l’ovocyte et joue un rôle dans le blocage de la maturation.
Il y a également des signaux qui sont envoyés de la granulosa vers l’ovocyte pour lui faire produire de l’AMPc.
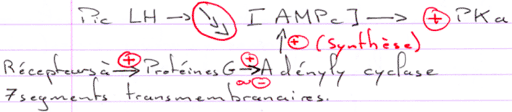

Le MPF intervient également sur la maturation de l’ovocyte et sur sa transition G2/M.
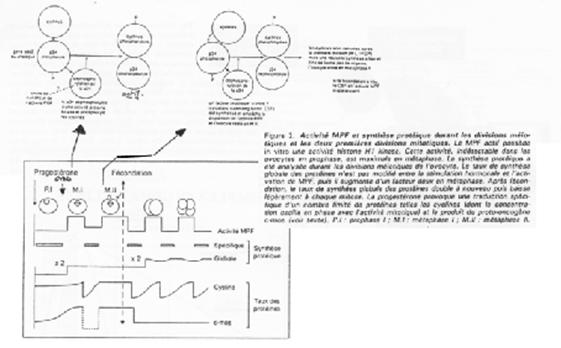
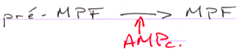
Le MPF est constitué de deux sous unités : p34cdc2 (Histone H1 kinase) et cycline B.
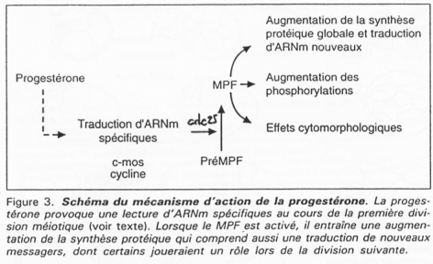
P34cdc2 est déphosphorisé par cdc25, ce qui active le MPF.
Les cibles/effets de p34cdc2 sont :
- Le noyau qui se décondense ;
- La rupture de la vésicule germinative par modification des lamines (PAGE 20. C) ;
- La condensation par phosphorylation de l’histone H1 ;
- L’activation des microtubules pour la formation du fuseau de microtubules.
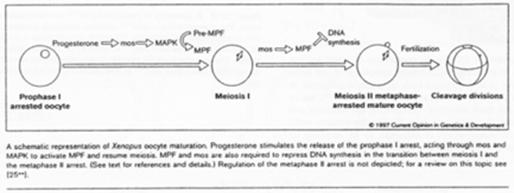
Chez les amphibiens, la maturation de l’ovocyte est différente.
Le déblocage nécessite le signal progestérone. Pour l’ovocyte, le récepteur à cette hormone est transmembranaire alors que normalement, les hormones stéroïdes ont un récepteur nucléaire.
La progestérone va activer c-mos (une kinase) qui va lancer la voie des Map-Kinases.
Chez la souris femelle, c-mos est déjà présent ; il n’y a pas besoin de le traduire.
La fin de la 1ère division se déroule ; il y a dégradation des cyclines ; une mini interphase de déroule ; la seconde division de méiose débute et se bloque en métaphase 2 ; le MPF reste actif.
C-mos = CSF (CytoStatic Factor).
C-mos entraîne la non dégradation des cyclines : le MPF reste actif et bloque en métaphase 2.
La fécondation.
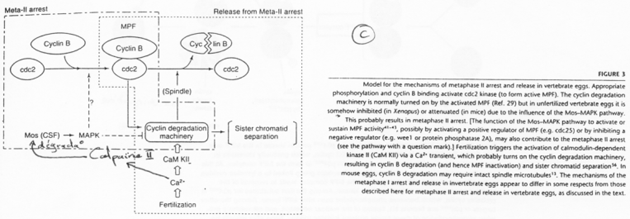
Les spermatozoïdes arrivent à la zone pellucide. Il y a entrée de l’un d’eux et activation de l’ovocyte. Cette activation provoque l’apparition d’une vague calcique (par PiP2). Celle-ci aboutit à la dégradation des cyclines par la dégradation de c-mos et à son action sur les cyclines.
C-mos est un garde-fou contre la parthénogenèse.
Quand les cellules de la granulosa reçoivent le pic de LH, elles vont synthétiser de l’acide hyaluronique (un carbo-hydrate) qui sera stocké dans l’antrum : il va y avoir gonflement de la cavité :
- li>Perte du contact entre les cellules du follicule et l’ovocyte ;
- Rupture du cumulus oophorus.
La rupture du follicule libère l’ovocyte.
E L’ovulation.

La synthèse de prostaglandines va déclencher sur les cellules de la granulosa stimulées, la production de métalloprotéines (des MMP) qui vont dégrader la lame basale du follicule.
Il y a une explosion folliculaire et donc, ponte ovulaire.
Remarque : avec l’ovocyte, il reste des cellules de la corona radiata.
Une fois libre, l’ovocyte se met à arborer des récepteurs à la LH.
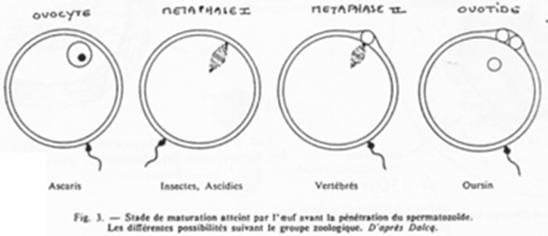
Les différents moments de fécondation en fonction du groupe zoologique.
Remarque sur les différents types d’œufs et leurs membranes protectrices.

Tableau de définitions.
Le chorion :
- Chez les amphibiens, c’est la membrane vitelline ;
- Chez la drosophile, on parle de coquille ;
- Chez les mammifères, c’est le trophectoderme.
Les membranes peuvent conditionner le développement.
V Annexes sur la lignée germinale.

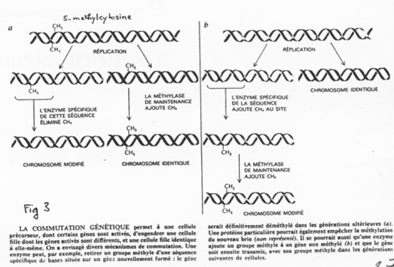
La création expérimentale d’un embryon avec deux pronucléi maternels ou deux paternels va toujours mourir. Ceci est du à l’empreinte génomique parentale.
Chez l’Homme on trouve environ 10 zones soumises à cette empreinte. C’est une empreinte épigénétique réalisée par méthylation de cytosines.
Pour les mammifères, il y a inhibition d’un chromosome « X » selon la lignée, au « hasard » (de préférence, celui d’origine mâle), pendant l’implantation du trophectoderme.
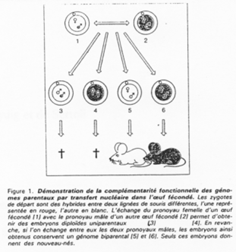
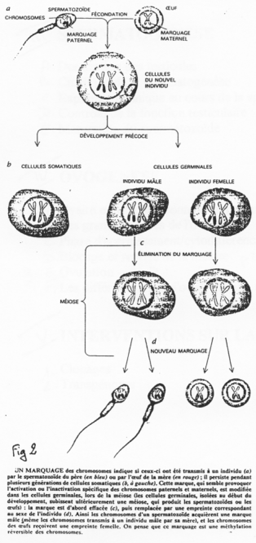
Aucun commentaire jusqu'à présent.