Immunologie :
Chapitre 4 : Les Anticorps.
Télécharger le document sur le serveur FTP ou sur le serveur web (HTTP).
I La bipolarité des Ig.
Les Ig ont :
- Une fonction de reconnaissance (parie hypervariable).
- Une fonction effectrice (destructrice) qui est réalisée grâce une partie commune (conservée) à toutes les Ig.
En réalité, on doit parler de fonctions effectrices. La partie commune :
- Permet de fixer le complément (série de protéines présentes dans le sérum) qui est activé par les Ac pour lyser les Ag.
- Permet le passage de la barrière placentaire pour protéger le fœtus d’agents pathogènes.
- Permet de traverser les différents épithéliums.
- Permet de fixer l’Ac sur certaines cellules (phagocytaires, tueuses).
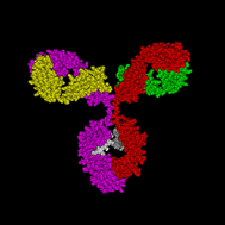
On a donc une dualité de fonctions qui entraîne une dualité de structures. La réponse polyclonale donne une hétérogénéité à la réponse immunitaire.
II Le modèle topologique des Ig.
La structure des Ig a été découverte entre 1959 et 1962. Cette découverte a rapporté un prix Nobel à Porter et à Eldman. Porter a essayé de cliver (avec des enzymes) la molécule (l’Ig) pour en détermine les différentes fonctions. Eldman, lui, a voulu réaliser un déroulage de l’Ig.
A Approche biochimique.
On réalise une hydrolyse ménagée avec de la papaïne (à partir des Ig d’un lapin). On obtient alors trois fragments I, II et III :
- Les fragments I et II sont capables de fixer l’Ag. De plus ces deux fractions se ressemblent beaucoup (identiques ?). Ils sont appelés les fragments Fab.
- Le fragment III ne reconnaît pas l’Ag et il cristallise à froid. Il est appelé fragment Fc.
- Chaque fragment pèse 50Kda. Ils forment deux sites de fixation pour l’Ag et un site effecteur.
B Approche chimique.
On détruit tous les ponts di-sulfures (S-S), puis on ajoute de l’urée à 8M. La mise en contact avec l’urée va permettre le déroulage des parties en 3D. On obtient alors quatre chaînes :
- Deux lourdes (H) de 50Kda
- Deux légères de 25Kda.
Ces chaînes sont retenues par des liaisons non-covalentes mais très fortes. On fait ensuite une chromatographie de partage. On obtient le graphe suivant :
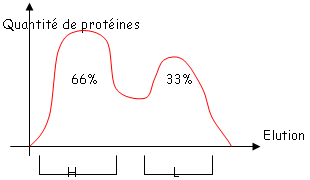
Ce graphe montre que l’on a une molécule symétrique.
C Approche immunochimique.
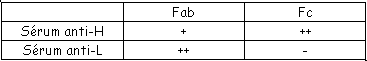
Tableau présentant les résultats des réactions entre les sérums anti-H et anti-L avec les fragments Fab et Fc.
D Modèle topologique des Ig.
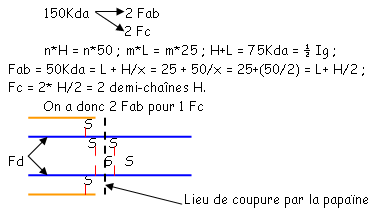
Quand on coupe avec de la pepsine, on obtient un fragment de 100Kda : ce sont les deux fragments Fab associés qui vont alors former le fragment Fab’2. Le fragment Fc est coupé en petits bouts qui rendent ce fragment invisible.
III Régions constantes et régions hypervariables.
On a deux types de chaînes L : les chaînes λ et κ. Par contre, on a plusieurs types de chaînes H. En 1965, Putman a séquencé la chaîne κ de souris, puis, celle de l’homme. La chaîne κ (comme la λ) est composée de 214 AA. La partie COOH terminale est très conservée. En position 191, on a de la valine ou de la leucine. La partie NH2 terminale est, elle, très variable. Hilochnam en a conclu qu’il y avait deux gènes différents (un pour la partie constante et un pour la partie variable).
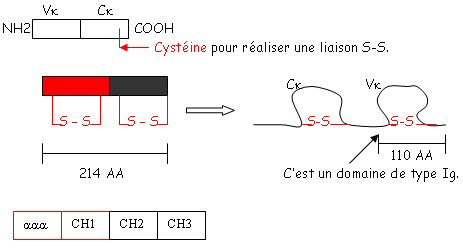
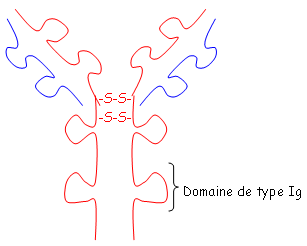
Les protéines qui ont ce domaine sont de la grande famille des Ig. Le site de fixation de l’Ag se trouve sur la chaîne L et sur la chaîne H. On distingue trois zones hypervariables où se fait la fixation : ce sont les CDR1, CDR2, CDR3.
D’un point de vue spatial, on a deux plans. Le premier plan est composé de trois feuillets β et le deuxième est composé de quatre des feuillets de même type. Ces deux plans sont liés par des liaisons S-S. Les régions variables sont situées en haut des petites boucles. Au niveau de la région charnière, on a beaucoup de proline et de cystéine qui permettent une grande flexibilité pour pouvoir fixer convenablement l’Ag. Les autres AA servent à maintenir la structure en place.
IV Les différentes classes et sous-classes d’Ig.
Les différences sont basées sur les chaînes H. On trouve :
- Les IgG : IgG1 66%, IgG2 23%, IgG3 7%, IgG4 4%.
- Les IgM.
- Les IgA : IgA1, IgA2, IgA3.
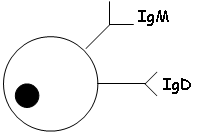
- Les IgD.
- Les IgE.
Ces différentes Ig ont des chaînes dont les tailles, les poids, les charges et les compositions sont différents.
A Les IgG.
Ce sont les IgG les plus importantes (70 à 75% des Ig totales). Elles ont un poids moléculaire de 146Kda. Les IgG3 sont toutefois plus lourdes car leur région charnière est plus longue. Ces IgG sont majoritaires dans la réponse secondaire.
On note des différences entre les quatre sous-classes. On trouve deux ponts S-S chez G1 et G4, quatre de ces ponts chez les G2 et quinze ponts chez les G3.
On trouve trois domaines constants sur la chaîne γ (3 CH).
Leur localisation est intra et extracellulaire. Elles ont un rôle anti-bactérien.
B Les IgM (fig.18).
Les IgM représentent 10% des Ig totales. Leur chaîne H pèse 65Kda. Ces chaînes H permettent de s’associer sous forme de pentamères (jusqu’à 970Kda). On les trouve seulement dans les compartiments extra-vasculaires. Elles permettent la destruction d’agents infectieux en majorité dans la réponse primaire. On trouve quatre domaines constants sur la chaîne µ (4 CH). Ces Ig sont très riches en oligosaccharides. Leur association en pentamère est possible grâce à la cystéine et à une chaîne J au centre. Il ne semble pas y avoir de liaison charnière.
Remarque : ces IgM ont une avidité pour fixer l’Ag.
C Les IgA (fig.17, 3 CH).
Elles représentent 15 à 20% des Ig totales. 80% de ces Ig sont monomériques et 20% sont sous forme de dimères (caractéristique spéciale à l’homme). On les trouve au niveau des muqueuses (salive, colostrum, lait, sécrétions trachéobronchiques et génitales) et de l’intestin.
Leur poids moléculaire est de 385Kda sous forme de dimère A1 et A2. Ces Ig sont associées à une pièce sécrétoire qui leur permet d’être sécrétée. La chaîne J permet la formation des dimères.
Les IgA se fixent sur les cellules épithéliales avec un récepteur qui est intégré par la cellule et qui va servir de pièce sécrétoire.
On trouve beaucoup d’IgA1 dans le sérum et les IgA2 dans les sécrétions (seuls les dimères vont être excrétés).
Ces IgA ont un rôle de protection des muqueuses.
D Les IgD (3 CH).
Elles possèdent trois domaines et sont principalement situées sur les membranes. Elles devraient participer à la différenciation des Lb.
E Les IgE.
On les trouve peu dans le sérum (on en a plus chez les allergiques). Elles sont présentent sur les membranes cellulaires (basophiles). Les basophiles et les mastocystes peuvent fixer IgE puis sécréter des histamines quand les IgE sont activées. Elles ont un rôle antiparasitaire et sont responsables des allergies. On trouve quatre domaines variables et pas de région CH.
V La génétique de la diversité.
Preyer et Bernett donnent l’hypothèse que les deux parties sont synthétisées par deux familles de gènes différentes. Tongawa a eu un prix Nobel dans les années 80.
A Organisation des gènes.
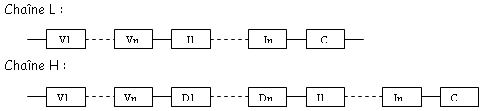
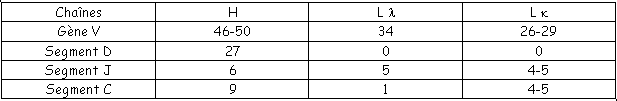
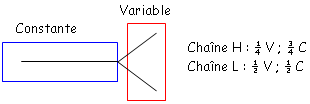
Le segment C correspond à la partie C. Les segments V, D, J constituent la partie variable.
Dans une cellule qui ne produit pas d’Ac, on a une grande distance entre le premier V et le codon C. L’ADN des cellules productrices d’Ac présente une distance beaucoup plus faible. L’ADN des cellules produisant des Ac est différent des autres cellules. Les 95 premiers acides aminés de la partie variable sont codés par le segment V et les autres par le segment J. La partie constante est codée par un fragment C.
1 La chaîne lourde.
![]()
2 Réarrangement.
Ce phénomène a lieu dans les Lb où l’ADN est modifié : un fragment V s’associe à un fragment J puis à un fragment C grâce à une recombinase (enzyme).
B La recombinaison.
1 La chaîne L.
La recombinaison a lieu pendant la fabrication d’un Lb.
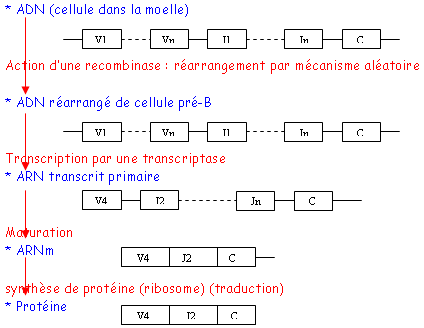
2 La chaîne H.
Le changement de l’ADN a aussi lieu pendant la fabrication du Lb.
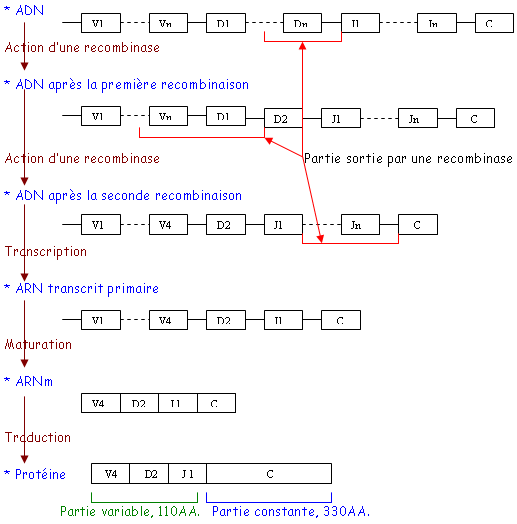
Chez les souris, il existe une faible diversité de chaînes λ. On note la présence de pseudo-gènes (exemple : le J-λ4). Pour les chaînes κ, on a beaucoup plus de différences : on a 350 V, 5 J et 1 C qui permettent 1400 regroupements différents.
En réalité, l’ADN est précédé d’un peptide signal :

Cette séquence leader permet l’entrée dans le RE. L’Ac va ensuite être transporté et deviendra membranaire ou sécrété. Le fragment L se trouve devant chaque fragment V1.
![]()
Pendant la vie fœtale, les fragments V les plus proches de J1 semblent être préférés. Dans les cancers de Lb, 85% des cellules utilisent les 20 V principaux.
C La diversité des Ig.
1 Recombinaison.
La chaîne légère est formée par les segments V et J. La chaîne lourde est synthétisée grâce aux fragments V, D et J. La chaîne κ de l’homme présente 150 possibilités, la chaîne λ en présente 150 et la chaîne H en présente 36000.
2 Variabilité et recombinaison.
• On a des coupures non-strictes et avec parfois des erreurs dues à la recombinase : ce sont des erreurs génétiques qui permettent des variations infinies par un, deux ou trois nucléotides.
• Les ajouts de nucléotides : cet ajout est possible grâce à une enzyme qui peut ajouter un ou plusieurs nucléotides.
3 Mutations somatiques.
Les mutations somatiques ont lieu presque tout le temps. Elle se déroule dans l’ADN qui code pour la partie du CDR (et généralement la troisième).
Les mutations somatiques sont des changements d’un ou deux nucléotides.
Ces mutations permettent une sélection des Lb qui ont une affinité de plus en plus importante. On observe beaucoup de ces mutations quand on a un passage d’un Lb à un plasmocyte (on parle de maturation d’affinité).
VI Les gènes de la région constante des chaines H.
Des Ig de types différents peuvent avoir la même partie variable. Une fois que celle-ci est sélectionnée, il peut y avoir des modifications de la partie constante.
Un myélome est un cancer des plasmocytes (un lymphome est un cancer des Lb) : on peut avoir une multiplication importante mais toujours avec la même partie variable. Ce grand taux de cet Ac a pu trouver des IgM et des IgG avec la même partie variable.
Le mécanisme de changement de chaîne H se fait après la recombinaison mais sans être dépendant.
Ces Ig ont la même partie variable : c’est une commutation de classe («switch »).
A La structure des gènes :
Chez la souris, on a plusieurs fragments C dans la chaîne H
![]()
Chez l’homme, on a la chaîne suivante :
![]()
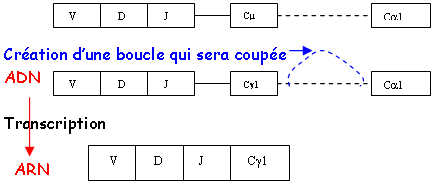
On note la présence d’un codon stop entre chaque gènes (allèles). Les gènes Cε1 et Cγ sont des pseudo-gènes. On compte plus de gènes que d’Ig. Après avoir enlevé les pseudo-gènes, on obtient un gène par sous-classe. Avant chaque gène C, on a une séquence particulière : la séquence «switch » (commutation de classe) : séquence S pour le site de recombinaison.
B Epissage différentiel (pour Cµ et C-delta).
Dans la transcription, on transcrit Cµ et Cδ.
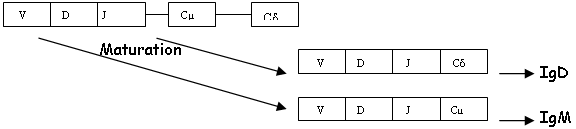
On a donc des Lb qui portent une IgM et à la fois une IgD.
C Recombinaison.
VII Ig membranaires et Ig sécrétées.
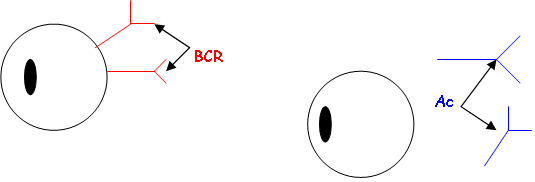
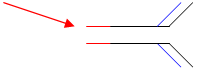
La seule différence est sur la partie C terminale. Les AA terminaux sont hydrophobes et servent à l’ancrage dans la membrane en formant des hélices α.
VIII La dynamique de la réponse avec anticorps.
A Rappel sur l’activation des Lb.
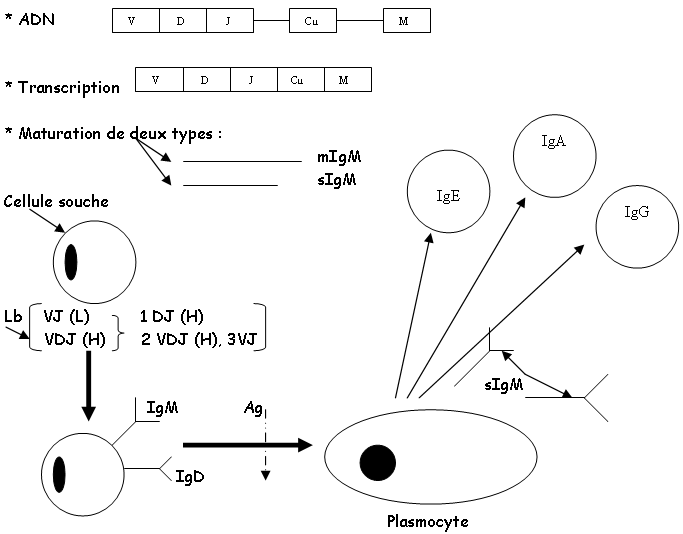
Les anticorps ont pour origine les cellules souches de la moelle osseuse.
- Les cellules pro-B : on assiste à la première recombinaison des chaines lourdes (D-J).
- Les cellules pré-B : on a la recombinaison qui donne la chaîne VDJ-µ.
- Les Lb immatures : on a une recombinaison qui donne la chaîne L (λ, κ) (IgM).
- Les Lb matures : on a des IgM et des IgD.
Ces quatre mécanismes se font en absence d’Ag. Ils vont ensuite quitter la moelle osseuse.
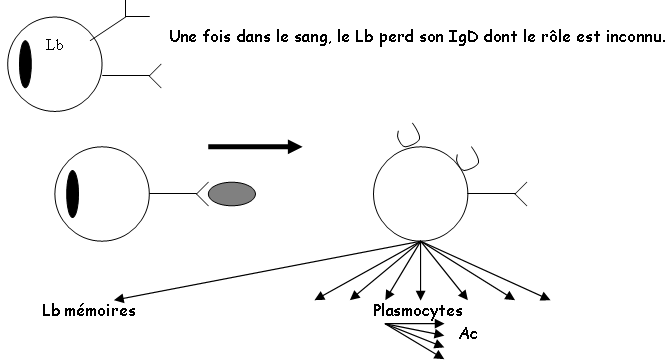
Les plasmocytes ont des RE et des Golgi très important (dans les tissus et les organes lymphoïdes secondaires).
B Les réponses I et II.
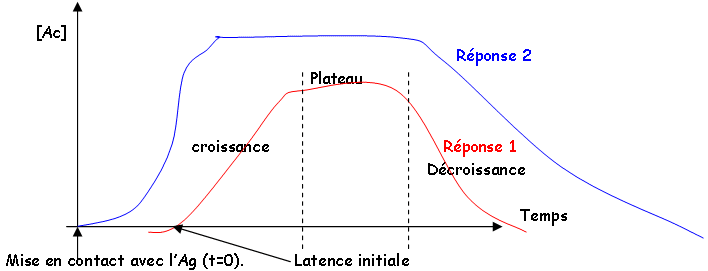
Phase de décroissance : catabolisme naturel des Ac (naturels)
Fixation sur l’Ag
Elimination de la circulation sanguine
La cinétique est différente entre les différentes réponses.
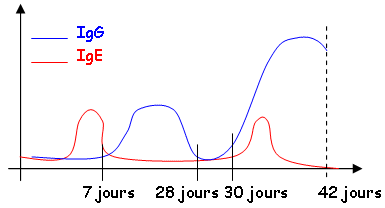
Les cinétiques sont différentes entre les différentes réponses (la secondaire est beaucoup plus rapide et sans latence). Il y a beaucoup plus d’Ac dans la réponse secondaire que dans la primaire (dix fois plus importante). Pendant la réponse primaire, on a surtout les IgM, pendant la réponse secondaire on a surtout des IgG. Affinité des Ac pour l’Ag.
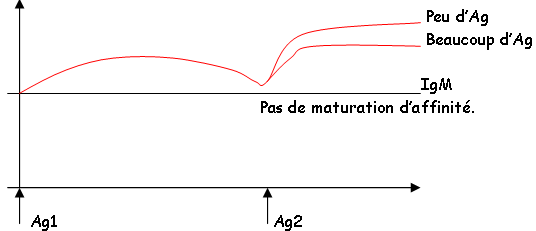
Dans la réponse primaire, on a des IgM et dans la réponse secondaire on a plutôt des IgG qui permettent d’augmenter l’affinité. Ce changement d’affinité varie en fonction de la quantité d’Ag. Quand on a peu d’Ag, les Lb sélectionnés sont ceux qui ont la meilleure affinité qui fonctionnent et aussi avec de nombreuses mutations somatiques en réponse secondaire.
Aucun commentaire jusqu'à présent.